
扫码体验VIP

扫码VIP小程序
创新药:创新药板块是指在股票市场中,专注于创新药物研发和生产的公司的集合。这些公司通常具有强大的研发实力和专业技术团队,致力于开发具有自主知识产权的创新药物。
- 板块介绍
- 板块百科
- 板块资讯
- 强势股票
创新药:政策支持创新药研发与审批提速,海外授权交易金额飙升,国内创新药获批数量创五年新高,产业迈向商业化爆发期
1、板块介绍
CFDA于2016年发布《化学药品注册分类改革工作方案》,对新药的定义是境内外均未上市的药品,并进一步分为1类新药(创新药)和2类新药(改良型新药)。
新注册分类1为创新药,强调是含有新的结构明确的、具有药理作用的化合物,且具有临床价值的原料药及其制剂,不包括改良型新药中2.1类的药品;新注册分类2为改良型新药,强调“优效性”,即相较于被改良的药品,具备明显的临床优势;新注册分类3为仿制境外上市但境内未上市原研药品的药品,大致相当于原有分类中的3类新药。
新药研发虽然存在着耗时长、费用高、成功率低等风险,但获批上市即可为药企贡献丰厚的利润。一直以来,全球医药巨头的主要盈利模式都是依靠处于专利期内的“重磅炸弹”型新药,凭借对现有疗法的替代或治疗领域空缺的填补占领市场。
目前我国大部分药企还处于仿创阶段,而随着药品政策环境不断改善,释放鼓励创新信号,产业迎来发展机遇。国内具有研发能力的创新药企不断涌现,老牌药企也纷纷布局。其中,生物类新药发展迅猛,中国有机会凭此弯道超车。
创新药为目前占我国医药市场的比重约9%,而其他G20国家的占比均在20%以上,美国、日本、德国等发达国家更是超过了50%。显示了通过创新药物在中国提升患者的生存质量仍有较大的提升空间。
2、创新药的类型:生物创新药和化学创新药
一般认为,化学创新药更灵活,生物创新药疗效更持久。化学创新药生产成本低,生物创新药生产成本高。
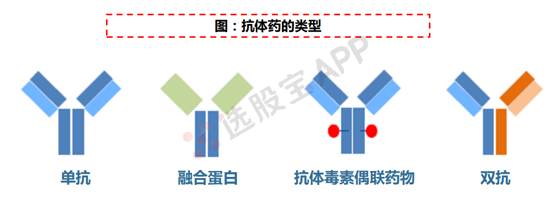
生物创新药又可以分为重组蛋白药物和抗体药物,其中抗体药物成为目前生物创新药的主流。抗体药物又可以按照抗体形式分为单抗、融合蛋白、抗体毒素偶联药物(ADC)和双抗。 单抗可以实现单靶向治疗,融合蛋白则可以对天然抗体进行重组,抗体毒素偶联药物则在抗体结构基础上实现杀伤增强,双抗可以实现双靶向。
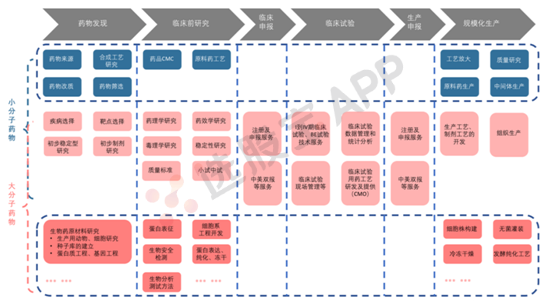
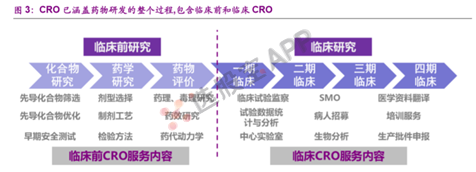
3、创新药研发和生产全流程
创新药的研发和生产流程包括药物发现、临床前研究、临床申报、临床试验、生产申报和规模化生产等环节。
4、创新药的新形式:细胞治疗和基因编辑
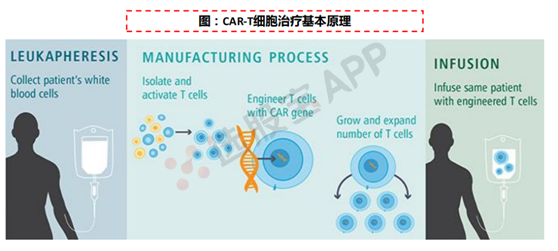
CAR-T,Chimeric Antigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法。通过将识别肿瘤相关抗原在体外进行基因重组,通过病毒侵染嵌合到患者T细胞,使患者T 细胞表达肿瘤抗原受体,经过纯化和大规模扩增后的T 细胞,也即CAR-T 细胞。
CAR-T细胞治疗在多种晚期血液肿瘤患者(白血病、淋巴瘤)患者中,仍可实现完全缓解(CR,CompleteResponse)的疗效。
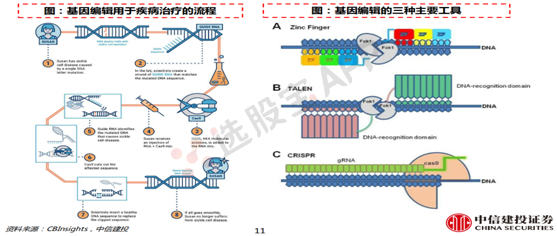
基因编辑又被誉为“基因的手术刀”,直接对引进疾病的突变/损伤基因进行编辑,从而修复病因。
5、CRO
CRO(Contract Research Organization)即合同研究组织,是指通过合同形式为医药企业在药物研发过程中提供专业化外包服务的组织或机构。CRO企业接受药企的委托,执行新药研究中的部分工作。
CRO具有三方面意义:
一是降低成本与风险分担。一般而言,CRO人员成本比大型药企低20-30%,研发外包在降低新药研发的成本的同时,可以提高药企研发的灵活性,降低风险;
二是降低研发难度。新药研发是一个复杂的系统工程,外包以及多方合作可以将研发过程分解,降低研发的复杂性,能够在一定程度上减小研发难度;
三是缩短研发周期。新药研发从药物发现到获批上市一般要耗时10-15年,由CRO承担的项目与药企自身承担的项目所需时间相比,大约可以节省1/3-1/4的时间。
6、CMO
即医药生产外包服务,通过合同形式为制药企业在药物生产过程中提供专业化服务,包括临床和商业化阶段的药物制备和工艺开发,涉及临床用药、中间体制造、原料药生产、制剂生产以及包装等服务。随着CMO市场趋于成熟,还衍生出定制生产(CDMO)、产研结合(CRO+CMO/CDMO)等多种模式。
7、政策推动下,创新药渗透率有望提升
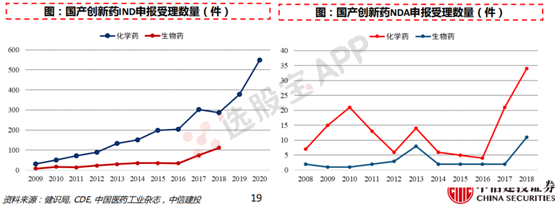
药政改革:提速新药审批,推动国内新药研发。
2011年到2014年,我国1.1类新药申报上市的平均审评时间从26个月增加到42个月,中国药企的等待时间是美国的3倍以上。药物审批速度缓慢引致多重积弊,推动中国药政改革。2015年7月,原国家食药监总局印发《关于开展药物临床试验数据自查核查工作的公告》,严查临床试验数据;2015年8月,2015年8月,原国家食药监总局公开承诺:三年内消化完近10年的新药申请积压存量,后顺利实现;2017年6月,中国正式成为全球ICH的成员国,不仅能让中国新药直接登陆欧美市场,也使全球新药引入中国的速度大大加快。
2018年,默沙东9价HPV疫苗从4月20日提交上市申请到4月28日获批,仅用时8天;梯瓦制药的氘代丁苯那嗪片在2020年上半年的新药审评中仅用139天便获批上市;拜耳的拜瑞妥、艾伯维的修美乐的多款适应症几乎与全球同步获批。2020 年,来自全球的至少40款新药在中国获批上市,同时,还有大约有30款药品获批了新适应症。
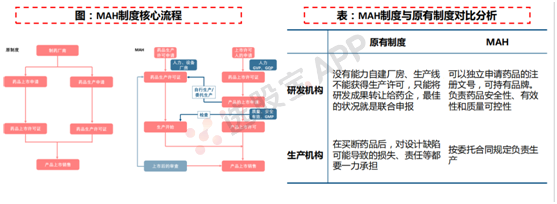
MAH制度:上市许可与生产许可分离
一款药品上市,必须有药品生产许可证、药品批准文号、GMP认证,分别证明一个企业有生产资质、药品研发技术合格、药品生产线合格。此前唯具有《药品生产许可证》的药品生产企业才能有药品批准文号、申请药品上市,并且禁止转让。
药品上市许可持有人(MAH, Marketing Authorization Holder)制度最大的特点,正是将药品上市许可与生产许可分离。MAH制度使研发人员、科研机构,有望成为药品上市许可持有人,可以独立申请药品的注册文号,可持有品牌。
2016年6月,MAH试点在北京、天津等10省(市)正式启动;2019年8月,新《药品管理法》发布,宣布于12月1日起正式在全国推广实施MAH制度。
医保谈判助力创新药快速放量:
近10年间批准上市的创新化学药和生物药大多数进入了新版医保目录,同时对于44个价格比较昂贵但临床价值较高的独家、专利药品进入谈判机制,最后36种谈判药品纳入医保乙类范围,并确定医保支付标准。
2018年10月,国家医保局又发布《关于将17种抗癌药纳入国家基本医疗保险、工伤保险和生育保险药品目录乙类范围的通知》,将阿扎胞苷、西妥昔单抗、奥西替尼等17种抗癌药品纳入医保目录乙类。
2019年新版医保目录的谈判工作正在有序进行,其中包括128个拟谈判品种以及31个续约品种。
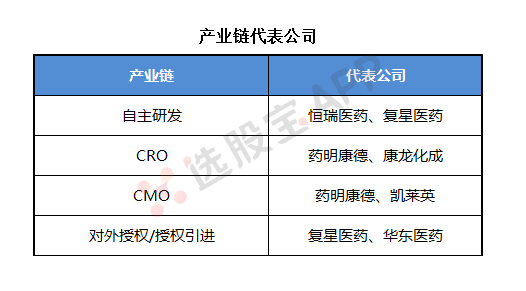
8、产业链核心公司
创新药板块解析
股票市场中的创新药概念及其相关企业
创新药板块名词解释
创新药板块是股票市场中的一个重要分支,涵盖了众多专注于创新药物研发和生产的上市公司。这些公司通过投入大量资金和时间进行研究开发,以寻求新的治疗方法或药物,满足临床需求并推动医药行业的发展。
什么是创新药
# 定义与特点
创新药,顾名思义,是指具有自主知识产权的原创药物。这些药物通常具有新颖的化学结构或新的治疗用途,在以前的研究文献或专利中未见报道。创新药的开发需要经历繁琐的临床试验和监管程序,具有较高的风险和不确定性。然而,一旦获得批准并成功上市,这些药物往往能带来巨大的市场收益。
# 研发流程
创新药的研发是一个复杂而漫长的过程。从实验室研究到临床试验,再到最终的上市销售,每一个环节都需要严格的科学验证和监管审批。这要求创新药企业具备强大的研发实力和专业技术团队,以确保药物的安全性和有效性。
# 市场前景
随着人们对健康需求的不断提高和医疗技术的不断进步,创新药市场呈现出巨大的增长潜力。特别是在肿瘤、血液病等领域,创新药的需求更为迫切。因此,创新药板块在股票市场中备受关注,成为投资者寻求高回报的重要选择。
# 相关企业
在创新药板块中,涌现出了一批具有代表性的企业。如北陆药业、仟源医药等,它们在国内医药对比剂、青霉素市场等领域具有领先地位;又如泰格医药、诺思格等,它们专注于为新药研发提供临床试验全过程专业服务。此外,还有香雪制药、皓元医药等企业,分别在中药、小分子药物研发等领域取得了显著成果。
总结
创新药板块是股票市场中一个充满机遇与挑战的领域。随着医疗技术的不断进步和市场需求的不断增长,创新药企业将迎来更加广阔的发展空间。投资者在关注创新药板块时,应充分了解企业的研发实力、市场前景以及潜在风险,以便做出明智的投资决策。
2026-02-25 14:47
创新药概念局部异动,长春高新尾盘涨停,三生国健、美迪西、荣昌生物、特宝生物等跟涨
2026-02-24 20:23
ST人福:拟向控股股东定增募资不超过30亿元-35亿元,,扣除相关发行费用后的募集资金净额拟用于创新药研发项目-子公司宜昌人福项目、创新药研发项目-总部研究院项目、两性健康及复杂制剂制造基地建设项目、数智化建设项目以及补充流动资金
2026-02-24 17:25
华森制药:子公司HSN002066C1片获得创新药《药物临床试验批准通知书》
2026-02-24 16:37
恒瑞医药:SHR-1918注射液药品上市许可申请获受理并纳入优先审评程序
2026-02-23 21:39
吉利德科学将收购Arcellx,旨在最大化Anito-cel的长期潜力
吉利德科学将以每股115美元现金(外加5美元或有价值权利,即CVR)收购Arcellx,隐含股权价值为78亿美元。 此次收购的核心是Anito-cel,这是一种针对复发/难治性多发性骨髓瘤的潜在“变革性”CAR-T疗法。 美国食品药品管理局(FDA)已受理Anito-cel的生物制品许可申请(BLA),预计PDUFA目标行动日期为2026年12月23日。 此次交易使吉利德获得Anito-cel的完全控制权,消除了原本的利润分成、里程碑付款和版税,并获得了Arcellx独特的D-Domain技术平台。
2026-02-23 17:04
百利天恒iza-bren晚期三阴性乳腺癌III期临床研究达到PFS和OS双终点
近日,由百利天恒自主研发的全球首创、新概念且唯一进入III期临床阶段的EGFR×HER3双抗ADC(iza-bren),在一项针对局部晚期或转移性三阴性乳腺癌(TNBC)的III期临床试验(研究编号:BL-B01D1-307)中,其预设的期中分析成功达到了PFS(无进展生存期)与OS(总生存期)双主要研究终点。这是iza-bren作为全球首创双抗ADC药物,在乳腺癌领域取得的首个III期研究阳性结果;同时,它也是iza-bren第3项达到主要研究终点的III期临床研究。适应症为既往经紫杉烷类治疗失败的不可手术切除的局部晚期或转移性三阴性乳腺癌。
2026-02-10 10:15
医药股震荡拉升,万邦德涨停,信立泰涨超6%,荣昌生物、汉森制药、千金药业、罗欣药业跟涨
2026-02-10 08:08
英矽智能:已与康哲药业达成药物研发战略合作
英矽智能在港交所公告,透过该合作,双方将在中枢神经系统及自身免疫疾病领域的多个项目上达成一系列由AI赋能的创新药物研发合作。根据该合作的协议条款,双方将结合英矽智能已验证的AI平台与AI赋能创新药研发能力,以及康哲药业经验丰富的研发团队和对疾病领域的深度认知,共同推进不少于2个研发项目的合作开发。同时,英矽智能有望就每个项目获得最高达数千万港元的研发费用支持。
2026-02-09 23:14
诺和诺德ADR回吐涨幅,美国FDA称其Wegovy减肥药广告虚假、或具有误导性
诺和诺德ADR涨幅收窄至不足3.7%,此前一度上涨7.2%。 美国食品药品管理局(FDA)告诉诺和诺德,其减肥药Wegovy电视广告要么是虚假的、要么具有误导性。 FDA在一封信函中要求诺和诺德在15个工作日内提供提供一份类似的促销通讯清单,以及停止此类通讯或停止分发Wegovy的计划。
2026-02-09 12:13
信达生物与礼来就创新药研发达成战略合作,最高可获85亿美元里程碑付款
2月8日,信达生物在港交所公告,本公司连同其附属公司信达生物制药(苏州)有限公司、Fortvita Biologics (Singapore) Pte. Ltd, Fortvita Biologics Inc.及Fortvita Biologics (USA), Inc.与礼来公司达成战略合作,携手推进肿瘤及免疫领域创新药物的全球研发。本次协议为双方第七次合作。根据合作协定,双方将发挥互补优势,加快推进创新药物的全球研发工作。本公司依托自身成熟的抗体技术平台及高效的临床能力,将主导相关项目从药物发现至中国临床概念验证(二期临床试验完成)的研发工作。根据协定,礼来获得相关项目在大中华区以外的全球独家开发与商业化许可,本公司保留相关项目在大中华区的全部权利。根据协定条款,本公司将获得3.5亿美元首付款;在达成后续特定里程碑事件后,本公司还有资格获得总额最高约85亿美元的研发、监管及商业化里程碑付款。此外,本公司有权就各产品在大中华区以外的净销售额获得梯度的销售分成。
2026-02-07 05:47
美国FDA采取行动打击“山寨版”减肥药,HIMS盘后跌超15.8%
美国食品药品管理局(FDA)采取行动,打击那些没有获得FDA审批的GLP-1药物。 FDA将打击那些那些具有误导性的、直接面向消费者(DTC)广告。 FDA谈及包括“平价减肥药”供应商Hims & Hers Health在内的配方药房。 企业不可以说未经审批的混合减肥药产品是仿制药。 Hims & Hers Health(HIMS)美股盘后跌15.86%,诺和诺德ADR涨2%。
2026-02-06 21:15
诺和诺德ADR止跌回升,美国FDA局长威胁封杀Hims & Hers仿制药丸
诺和诺德美股盘前涨幅扩大至7.18%,本周稍早已经因盈利担忧和评价减肥药供应商Hims & Hers推出每个月49美元的“山寨版”Wegovy减肥药而暴跌21%;HIMS盘前则跌8.65%。 美国食品药品监督管理局(FDA)局长暗示,可能封杀Hims & Hers推出的低价Wegovy仿制药,这被视为诺和诺德的重大利好。专家指出,Hims & Hers的脂质体口服配方可能无法有效被肠道吸收,而诺和诺德拥有专利保护的SNAC吸收技术。
2026-02-05 08:00
云顶新耀:获得MT1013在中国及亚太区独家商业化授权,首付款2亿元
云顶新耀在港交所公告,于2026年2月4日,本公司的间接全资附属公司云顶新耀医药科技有限公司与陕西麦科奥特医药科技股份有限公司订立协议,据此麦科奥特已不可撤销授予该附属公司于中国及亚太区( 日本除外 )的MT1013的独家商业化授权,MT1013为全球首创的双靶点受体激动剂多肽 ,可同时靶向钙敏感受体(Ca SR)及成骨生长肽(OGP) 受体,开发主要用于治疗继发性甲状旁腺功能亢进症(SHPT),其中国III期临床研究正在进行中及相关临床开发费用将由麦科奥特承担。根据独家授权,该附属公司的付款义务包括:(i)首付款人民币200百万元;及(ii) 最高达人民币1,040百万元的潜在监管及商业里程碑付款。
2026-02-04 05:08
美股减肥药概念股周二哀鸿遍野,诺和诺德在披露业绩报告后暴跌超14.6%
诺和诺德ADR收跌14.64%,硕迪生物跌6.75%,Goodrx跌5.26%,礼来跌3.9%,平价减肥药供应商Hims & Hers跌3.4%,辉瑞制药跌3.34%,阿斯利康跌2.17%,制药ETF跌1.86%,Viking Therapeutics跌1.7%,福泰制药跌1.36%,渤健BIIB跌1.3%。
2026-02-02 19:38
润都股份:公司目前有1类创新药(化学药)盐酸去甲乌药碱注射液(规格:2ml:2.5mg)及其原料药,其药品审评工作正在有序进行。创新药具有研发周期长,投入大,风险高的特点,药品能否获批上市以及获批上市的时间、上市后的生产和销售情况存在不确定性,短期内也不会对公司业绩产生重大影响
| ID | 股票名称 | 涨幅% | 现价 | 换手率% | 总市值 | 炒作逻辑 |
|---|
-
VIP复盘工具
- 更多复盘工具
- 股票复盘百科
-
股票复盘知识
- 掌握投资智慧,避免失控之旅
- 山顶资本:股市中的散户传奇与投资策略反思
- 透视股市庄家:行为解析与策略构建
- 成交量解密:捕捉翻倍牛股的钥匙
- 草根股神的股市征途:逻辑、装备与文艺梦
- 把握多头市场节奏:各阶段的投资策略解析
- 弱市超短线交易:掌握卖点技巧,解锁盈利之门
- 洞悉股市庄家动向:四维度解析拉升前兆
- 可转债投资新策略:把握板块脉络,精准参与主线机会
- MACD柱线的深度剖析与实战应用
- 警惕诱多陷阱:揭秘五种典型庄家手法
- 短线炒股策略深度解析:掌握绝招,稳健盈利
- 如何在股市中稳抓牛股,实现资产翻倍?
- 揭秘中线牛股的K线形态:精准捕捉黑马股的关键特征
- 筛选潜力股的四大黄金法则
- MACD波段买卖法:精准捕捉市场波动的秘籍
- 精准捕捉市场热点:多维度分析热点持续性
- 揭秘涨停回马枪战法:精准低吸的实战艺术与逻辑剖析
- 股市智慧:老散户的十大黄金法则揭秘
- 精准捕捉个股底部信号:多维度解析与实战策略
当前版本:V3.0




 VIP复盘网
VIP复盘网
