
扫码关注公众号

扫码VIP小程序
创新药:创新药板块是指在股票市场中,专注于创新药物研发和生产的公司的集合。这些公司通常具有强大的研发实力和专业技术团队,致力于开发具有自主知识产权的创新药物。
- 板块介绍
- 板块百科
- 板块资讯
- 强势股票
创新药:创新药作为医药板块的核心资产,具有广阔的市场前景和高成长潜力
1、板块介绍
CFDA于2016年发布《化学药品注册分类改革工作方案》,对新药的定义是境内外均未上市的药品,并进一步分为1类新药(创新药)和2类新药(改良型新药)。
新注册分类1为创新药,强调是含有新的结构明确的、具有药理作用的化合物,且具有临床价值的原料药及其制剂,不包括改良型新药中2.1类的药品;新注册分类2为改良型新药,强调“优效性”,即相较于被改良的药品,具备明显的临床优势;新注册分类3为仿制境外上市但境内未上市原研药品的药品,大致相当于原有分类中的3类新药。
新药研发虽然存在着耗时长、费用高、成功率低等风险,但获批上市即可为药企贡献丰厚的利润。一直以来,全球医药巨头的主要盈利模式都是依靠处于专利期内的“重磅炸弹”型新药,凭借对现有疗法的替代或治疗领域空缺的填补占领市场。
目前我国大部分药企还处于仿创阶段,而随着药品政策环境不断改善,释放鼓励创新信号,产业迎来发展机遇。国内具有研发能力的创新药企不断涌现,老牌药企也纷纷布局。其中,生物类新药发展迅猛,中国有机会凭此弯道超车。
创新药为目前占我国医药市场的比重约9%,而其他G20国家的占比均在20%以上,美国、日本、德国等发达国家更是超过了50%。显示了通过创新药物在中国提升患者的生存质量仍有较大的提升空间。
2、创新药的类型:生物创新药和化学创新药
一般认为,化学创新药更灵活,生物创新药疗效更持久。化学创新药生产成本低,生物创新药生产成本高。
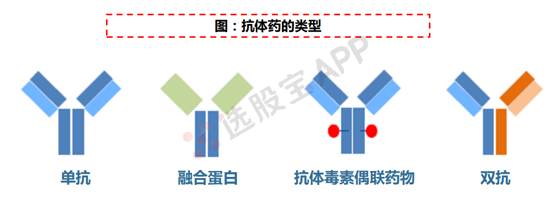
生物创新药又可以分为重组蛋白药物和抗体药物,其中抗体药物成为目前生物创新药的主流。抗体药物又可以按照抗体形式分为单抗、融合蛋白、抗体毒素偶联药物(ADC)和双抗。 单抗可以实现单靶向治疗,融合蛋白则可以对天然抗体进行重组,抗体毒素偶联药物则在抗体结构基础上实现杀伤增强,双抗可以实现双靶向。
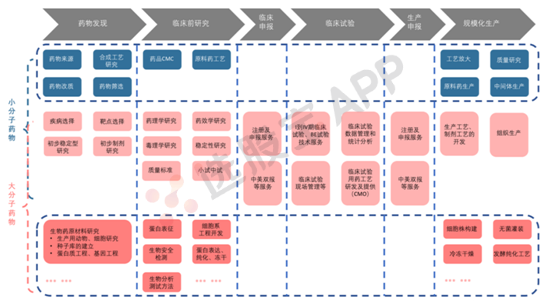
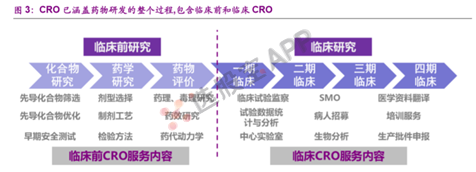
3、创新药研发和生产全流程
创新药的研发和生产流程包括药物发现、临床前研究、临床申报、临床试验、生产申报和规模化生产等环节。
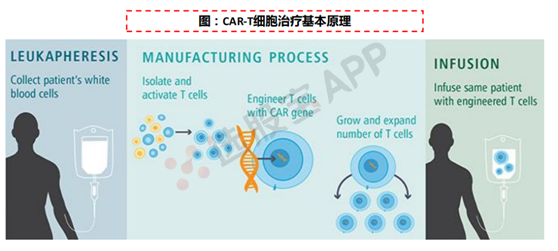
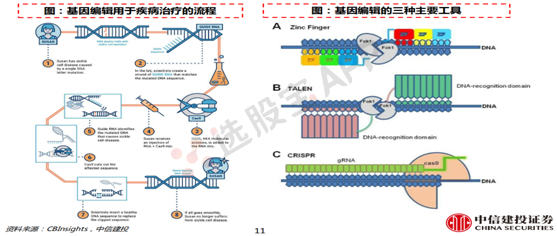
4、创新药的新形式:细胞治疗和基因编辑
CAR-T,Chimeric Antigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法。通过将识别肿瘤相关抗原在体外进行基因重组,通过病毒侵染嵌合到患者T细胞,使患者T 细胞表达肿瘤抗原受体,经过纯化和大规模扩增后的T 细胞,也即CAR-T 细胞。
CAR-T细胞治疗在多种晚期血液肿瘤患者(白血病、淋巴瘤)患者中,仍可实现完全缓解(CR,CompleteResponse)的疗效。
基因编辑又被誉为“基因的手术刀”,直接对引进疾病的突变/损伤基因进行编辑,从而修复病因。
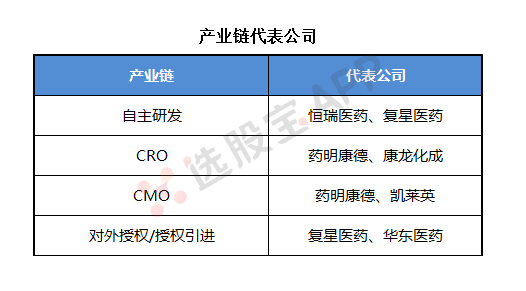
5、CRO
CRO(Contract Research Organization)即合同研究组织,是指通过合同形式为医药企业在药物研发过程中提供专业化外包服务的组织或机构。CRO企业接受药企的委托,执行新药研究中的部分工作。
CRO具有三方面意义:
一是降低成本与风险分担。一般而言,CRO人员成本比大型药企低20-30%,研发外包在降低新药研发的成本的同时,可以提高药企研发的灵活性,降低风险;
二是降低研发难度。新药研发是一个复杂的系统工程,外包以及多方合作可以将研发过程分解,降低研发的复杂性,能够在一定程度上减小研发难度;
三是缩短研发周期。新药研发从药物发现到获批上市一般要耗时10-15年,由CRO承担的项目与药企自身承担的项目所需时间相比,大约可以节省1/3-1/4的时间。
6、CMO
即医药生产外包服务,通过合同形式为制药企业在药物生产过程中提供专业化服务,包括临床和商业化阶段的药物制备和工艺开发,涉及临床用药、中间体制造、原料药生产、制剂生产以及包装等服务。随着CMO市场趋于成熟,还衍生出定制生产(CDMO)、产研结合(CRO+CMO/CDMO)等多种模式。
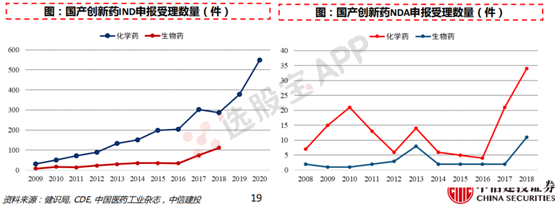
7、政策推动下,创新药渗透率有望提升
药政改革:提速新药审批,推动国内新药研发。
2011年到2014年,我国1.1类新药申报上市的平均审评时间从26个月增加到42个月,中国药企的等待时间是美国的3倍以上。药物审批速度缓慢引致多重积弊,推动中国药政改革。2015年7月,原国家食药监总局印发《关于开展药物临床试验数据自查核查工作的公告》,严查临床试验数据;2015年8月,2015年8月,原国家食药监总局公开承诺:三年内消化完近10年的新药申请积压存量,后顺利实现;2017年6月,中国正式成为全球ICH的成员国,不仅能让中国新药直接登陆欧美市场,也使全球新药引入中国的速度大大加快。
2018年,默沙东9价HPV疫苗从4月20日提交上市申请到4月28日获批,仅用时8天;梯瓦制药的氘代丁苯那嗪片在2020年上半年的新药审评中仅用139天便获批上市;拜耳的拜瑞妥、艾伯维的修美乐的多款适应症几乎与全球同步获批。2020 年,来自全球的至少40款新药在中国获批上市,同时,还有大约有30款药品获批了新适应症。
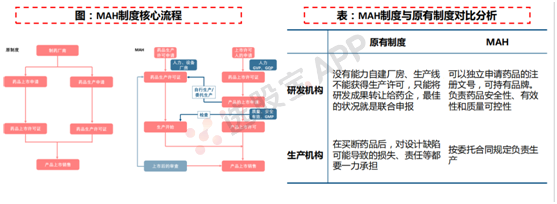
MAH制度:上市许可与生产许可分离
一款药品上市,必须有药品生产许可证、药品批准文号、GMP认证,分别证明一个企业有生产资质、药品研发技术合格、药品生产线合格。此前唯具有《药品生产许可证》的药品生产企业才能有药品批准文号、申请药品上市,并且禁止转让。
药品上市许可持有人(MAH, Marketing Authorization Holder)制度最大的特点,正是将药品上市许可与生产许可分离。MAH制度使研发人员、科研机构,有望成为药品上市许可持有人,可以独立申请药品的注册文号,可持有品牌。
2016年6月,MAH试点在北京、天津等10省(市)正式启动;2019年8月,新《药品管理法》发布,宣布于12月1日起正式在全国推广实施MAH制度。
医保谈判助力创新药快速放量:
近10年间批准上市的创新化学药和生物药大多数进入了新版医保目录,同时对于44个价格比较昂贵但临床价值较高的独家、专利药品进入谈判机制,最后36种谈判药品纳入医保乙类范围,并确定医保支付标准。
2018年10月,国家医保局又发布《关于将17种抗癌药纳入国家基本医疗保险、工伤保险和生育保险药品目录乙类范围的通知》,将阿扎胞苷、西妥昔单抗、奥西替尼等17种抗癌药品纳入医保目录乙类。
2019年新版医保目录的谈判工作正在有序进行,其中包括128个拟谈判品种以及31个续约品种。
8、产业链核心公司
创新药板块解析
股票市场中的创新药概念及其相关企业
创新药板块名词解释
创新药板块是股票市场中的一个重要分支,涵盖了众多专注于创新药物研发和生产的上市公司。这些公司通过投入大量资金和时间进行研究开发,以寻求新的治疗方法或药物,满足临床需求并推动医药行业的发展。
什么是创新药
# 定义与特点
创新药,顾名思义,是指具有自主知识产权的原创药物。这些药物通常具有新颖的化学结构或新的治疗用途,在以前的研究文献或专利中未见报道。创新药的开发需要经历繁琐的临床试验和监管程序,具有较高的风险和不确定性。然而,一旦获得批准并成功上市,这些药物往往能带来巨大的市场收益。
# 研发流程
创新药的研发是一个复杂而漫长的过程。从实验室研究到临床试验,再到最终的上市销售,每一个环节都需要严格的科学验证和监管审批。这要求创新药企业具备强大的研发实力和专业技术团队,以确保药物的安全性和有效性。
# 市场前景
随着人们对健康需求的不断提高和医疗技术的不断进步,创新药市场呈现出巨大的增长潜力。特别是在肿瘤、血液病等领域,创新药的需求更为迫切。因此,创新药板块在股票市场中备受关注,成为投资者寻求高回报的重要选择。
# 相关企业
在创新药板块中,涌现出了一批具有代表性的企业。如北陆药业、仟源医药等,它们在国内医药对比剂、青霉素市场等领域具有领先地位;又如泰格医药、诺思格等,它们专注于为新药研发提供临床试验全过程专业服务。此外,还有香雪制药、皓元医药等企业,分别在中药、小分子药物研发等领域取得了显著成果。
总结
创新药板块是股票市场中一个充满机遇与挑战的领域。随着医疗技术的不断进步和市场需求的不断增长,创新药企业将迎来更加广阔的发展空间。投资者在关注创新药板块时,应充分了解企业的研发实力、市场前景以及潜在风险,以便做出明智的投资决策。
2025-07-09 10:28
创新药概念股震荡拉升,普蕊斯、九芝堂涨停,美迪西涨超15%,塞力医疗、科兴制药、恒瑞医药等纷纷上扬
2025-07-08 18:04
舒泰神:STSA-1002注射液(急性呼吸窘迫综合征适应症)获得Ib II期临床研究总结报告
2025-07-08 17:12
联环药业:LH-1801项目当前仍处于研发阶段,预计在未来相当一段时间内不会对公司的营业收入和经营业绩产生重大影响
2025-07-08 12:27
先声药业:乐德奇拜单抗新药上市申请(NDA)获国家药品监督管理局受理,用于治疗成人及青少年特应性皮炎
2025-07-08 09:34
创新药概念股继续走强,联环药业2连板,哈三联涨停,海南海药、广生堂、睿智医药、前沿生物等跟涨
2025-07-07 18:58
以岭药业:化药创新药G201-Na胶囊临床试验申请获得批准
2025-07-07 13:44
创新药概念震荡回落,科兴制药跌超15%,荣昌生物、君实生物、贵州百灵、汇宇制药、长春高新等跌幅居前
2025-07-07 09:38
创新药概念股再度上扬,联环药业涨停,微芯生物、广生堂涨超10%,塞力医疗、先达股份、华纳药厂等纷纷拉升
2025-07-06 20:37
国家抗HIV耐药研究新规发布,艾迪药业深度参与
艾迪药业7月6日消息,近日,国家药监局药品审评中心发布《抗HIV感染药物临床耐药性研究及数据递交指导原则》,为抗HIV药物研发筑牢规范根基。值得关注的是,早在2024年9月,作为国内抗HIV研发药企的领军者,艾迪药业受邀参加了该指导原则征求意见稿的专家咨询会,深度参与其中。
2025-07-04 19:37
热景生物:公司目前的主营业务是研发、生产和销售体外诊断试剂及配套仪器,生物创新药及肿瘤早筛等相关业务分别由公司联营企业舜景医药、尧景基因、智源生物和翱锐生物等独立运营,相关业务具有研发投入大、研发风险高的特点
2025-07-04 18:29
广生堂:公司关注到,公司乙肝治疗创新药GST-HG131被国家药品监督管理局药品审评中心拟纳入突破性治疗品种名单并公示,公示期7日。除前述信息外,公司未发现近期公共传媒报道了可能或已经对本公司股票交易价格产生较大影响的未公开重大信息
2025-07-04 17:19
塞力医疗:公司关注到近期市场对创新药业务关注度较高。公司旗下联营企业华纪元生物是公司于2020年1月投资的参股公司,持有其15.61%的股份,投资金额1,066.6万元,华纪元生物2024年营业收入2.68万元,净利润-238.23万元。其治疗性降压疫苗项目HJY-ATRQβ-001已完成概念验证(POC)阶段研究和临床前研究,已于2025年6月6日获得国家药监局(NMPA)的新药临床试验申请(IND)受理,后续还需经一期、二期临床试验,试验能否成功还存在重大不确定性。上述投资目前对公司主营业务的影响较小
2025-07-04 13:11
创新药概念股涨势扩大,广生堂、热景生物均20cm涨停,塞力医疗、海正药业、奥赛康等多股封板,神州细胞、汇宇制药涨超10%
2025-07-04 10:37
四川:全力争取聚变堆关键技术攻关工程落地实施,推动核医疗全产业链创新突破
四川省人民政府办公厅印发《关于发展壮大新兴产业加快培育未来产业的实施方案(2025—2027年)》。其中提到,加快建设准环对称仿星器,全力争取聚变堆关键技术攻关工程落地实施,开展氘氚燃烧、聚变材料等研制,提升真空器件、涉氚阀门等配套零部件生产能力。依托中国工程物理研究院,加快建设电磁驱动聚变大科学装置,全力争取高效激光聚变能源工程落地实施,开展大能量激光器、重频靶等研制,拓展新型功能材料研发、激光加工等方面应用场景和商业化应用。推动核医疗全产业链创新突破。依托乐山核技术应用产业园,提升堆照医用同位素分离提纯生产能力,实现镥-177、钼-99、钇-90、铜-64等主要同位素稳定供应。加快精准靶向放射性创新药物研发,推动一批新药上市。依托绵阳核医疗健康产业园,加快 FLASH(闪光)放射治疗装备型号验证、尽早实现量产,促进硼中子俘获治疗设备、多室质子治疗设备、重离子治疗设备产业化进程。
2025-07-03 18:51
科兴制药:公司在研的多个创新药项目尚处于临床前阶段。公司特别提醒广大投资者,创新药具有高科技、高风险、高附加值的特点,药品从研制、临床试验报批到投产前的周期长、环节多,后续研究进程、研究结果及审批结果、上市销售等尚存在诸多不确定性
| ID | 股票名称 | 涨幅% | 现价 | 换手率% | 总市值 | 炒作逻辑 |
|---|
-
VIP复盘工具
- 更多复盘工具
- 股票复盘百科
-
股票复盘知识
- 低位补仓的艺术:策略、技法与陷阱识别
- 短线操作的智慧与艺术:精准捕捉,稳健获利
- 股民如何精准捕获优质成长股
- 股票行情时间节点深度剖析与策略构建
- 揭秘均线逃顶绝技:20/30通道战法实战分析
- 分时图战术:精准捕捉低吸高抛的黄金时机
- 股市航行:解锁不同阶段的最优解套策略
- 熊市生存法则:短线高手的五大策略与心态剖析
- 从涨幅榜中洞悉牛股奥秘:策略与实践
- 从上下影线中寻找股市战机:深度解析与实战策略
- 从20万到8亿的股市操盘智慧:深度剖析与实战心得
- 揭秘股市操纵术:高卖低买的砸盘策略与散户应对之道
- 反常心理:股票投资中的隐形翅膀
- 股民炒股的五个成长阶段:从懵懂到成精的蜕变
- 倍量阴线战术:深度解析擒涨停策略
- 识破空头陷阱:多维度分析助您稳健投资
- 股市涨跌之谜:揭秘影响股市的关键因素与交易智慧
- 挖掘10元潜力股的全面攻略
- MACD指标深度解析:精准捕捉市场信号,提升交易执行力
- 通过四根K线洞察股市大盘底部信号
当前版本:V3.0




 VIP复盘网
VIP复盘网
