
近日,复星医药宣布,控股子公司药友制药、复星医药产业与Pfizer Inc.(辉瑞)共同签订《许可协议》,由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)激动剂(包括YP05002)及含有该活性成分的产品授予辉瑞于全球范围独家开发、使用、生产及商业化的权利,许可领域包括人类、动物所有适应症的治疗、诊断及预防。
ZHANG TONG SHE
根据协议条款,药友制药将完成YP05002于澳大利亚的I期临床试验,并授予辉瑞在全球范围内进一步开发、生产和商业化的独家许可。药友制药将获得1.5亿美元的首付款,并有资格获得与特定开发、注册和商业里程碑相关的最高达19.35亿美元的里程碑付款,以及产品获批销售后的分层特许权使用费。
这也意味着,若研发进展顺利,公司最高将获得近150亿元人民币的许可金额(含后续销售里程碑付款)。

公告显示,本次许可的小分子胰高血糖素样肽-1受体(GLP-1R)激动剂由复星医药子公司药友制药自主研发并拥有自主知识产权,拟用于代谢领域相关疾病的治疗,潜在适应症包括但不限于长期体重管理、2型糖尿病、代谢功能障碍相关脂肪性肝炎(MASH)等,目前于澳大利亚处于临床I期阶段。
复星医药董事长陈玉卿表示:“此次与辉瑞达成全球合作,是复星医药创新引领和深度国际化战略的又一重要里程碑。复星医药始终致力于解决未被满足的临床需求,我们期待与辉瑞携手,加速YP05002的全球开发和商业化进程,旨在共同努力应对肥胖和代谢性疾病患者面临的挑战。”
今年以来,复星医药全球化运营能力进一步加强,持续在创新研发、许可引进、生产运营及商业化等多维度践行国际化战略。前三季度,复星医药创新药品BD不断突破,全球化的双向许可合作持续加强。
除此次与辉瑞合作之外,今年8月,复星医药控股子公司复星医药产业与英国生物技术企业Sitala达成《许可协议》,将向Sitala授予小分子抑制剂FXS6837及含有该活性成分的产品于全球范围(除中国区外)的开发、生产及商业化权利,许可领域包含人类、动物疾病的诊断和治疗。
根据许可协议,Sitala将向复星医药产业支付至多1.9亿美元不可退还的首付款、开发及商业化里程碑付款,同时,复星医药产业可以零对价获得价值500万美元的Sitala的股份。未来,基于许可产品于许可区域的年度净销售额达成情况,Sitala将向复星医药产业依约支付至多4.8亿美元的销售里程碑款项。
产品出海方面,截至10月,复星医药自主研发的创新型PD-1抑制剂汉斯状(斯鲁利单抗注射液)联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)的美国桥接试验已完成全部200例患者入组,将为后续向美国食品药品监督管理局(FDA)递交生物制品许可申请(BLA)奠定坚实基础。斯鲁利单抗注射液是全球首个获批用于一线治疗ES-SCLC的抗PD-1单抗,已在中国、英国、德国、新加坡、印度等近40个国家和地区获批上市。
2025年10月,注射用HLX43(靶向PD-L1抗体偶联药物)用于胸腺上皮肿瘤(TETs)治疗获美国FDA的孤儿药资格认定(Orphan-drug Designation),将有助于该药品相关适应症在美国的后续研发、注册及商业化进程。
值得注意的是,日前,国家医保局、人力资源社会保障部印发《国家基本医疗保险、生育保险和工伤保险药品目录》(下称“新版国家医保目录”)、首版《商业健康保险创新药品目录》(下称“首版商保创新药目录”)。复星医药旗下包括CAR-T产品阿基仑赛注射液、芦沃美替尼片等多款已上市产品获新进或新增适应症纳入新版国家医保目录、首版商保创新药目录。
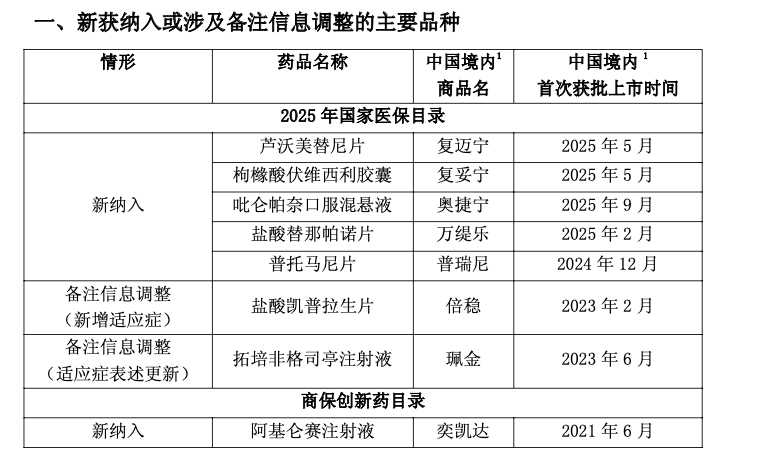
复星医药表示,前述新获纳入或涉及备注信息调整的药品2024年及2025年前三季度的销售额合计分别约为4.01亿元、8.92亿元,分别约占同期营收的0.98%、3.04%。



 VIP复盘网
VIP复盘网
