5月30日-6月3日,2025年美国临床肿瘤学会(ASCO)年会将在美国芝加哥举行。ASCO年会是全球肿瘤领域最权威的学术交流盛会,每年都会展示当前国际最前沿的临床肿瘤学科研成果和治疗技术。
5月22日,ASCO年会摘要全文公布,多款国产新药披露了亮眼的临床数据,医药魔方挑战具有重大临床突破意义的10项进行介绍。
产品:ZG005
药物靶点 类型:PD-1/TIGIT双抗
公司:泽璟制药
全球研发赛道排名:2/7
本次公布结果的I/II期研究分为两部分,Part 1为剂量递增研究,Part 2评估ZG005(10mg/kg或20mg/kg) 化疗±贝伐珠单抗的疗效和安全性。
截至2024年12月19日,Part 1和Part 2分别纳入了12例和29例晚期宫颈癌患者,其中53.7%的患者在研究中接受了贝伐珠单抗治疗。在28例可评估疗效的患者中,10mg/kg和20mg/kg剂量组未确认的客观缓解率(ORR)分别为69.2%(9/13)和80.0%(12/15)。
Part 1未观察到剂量限制性毒性(DLT)。在41例患者中评估的安全性数据显示,治疗相关不良事件(TRAE)发生率为75.6%(31/41),1-2级TRAE最为常见,3级及以上TRAE发生率为29.3%(12/41)。没有患者因TRAE停药或死亡。10mg/kg剂量组有1例患者报告严重不良事件(SAE)——双侧肺部肺炎,20mg/kg剂量组未发生SAE。
产品:艾多替尼(TY-9591)
药物靶点 类型:EGFR T790M抑制剂
公司:同源康医药
全球研发赛道排名:12/17
本次公布结果的II期研究纳入了29例非小细胞肺癌(NSCLC)脑转移患者,其中27例为未接受过EGFR-TKI治疗的EGFR敏感突变(19 Del和L858R)患者,2例为EGFR耐药突变(EGFR T790M)患者。截至2024年3月21日,中位随访时间为16.4个月。
结果显示,研究者评估的颅内客观缓解率(iORR)为93.1%,其中EGFR敏感突变患者的iORR为92.6%,EGFR耐药突变患者实现颅内部分缓解(iPR)。中位颅内缓解持续时间(iDOR)和中位颅内无进展生存期(iPFS)尚未达到,iDOR达到12个月的患者比例为82.8%,iPFS达到12个月的患者比例为96.6%。此外,总人群的中位PFS为13.5个月,EGFR敏感突变患者的中位PFS为15.1个月。
安全性方面,TRAE发生率为93.1%(27/29),3级及以上TRAE发生率为27.6%(8/29),无4-5级AE发生,SAE发生率为17.2%(5/29)。没有患者出现间质性肺炎、心肌病变和角膜炎。
产品:TQB2102
药物靶点 类型:HER2双抗ADC
公司:正大天晴
全球研发赛道排名:2/7
本次ASCO大会,TQB2102有三项研究入选,其中2项为数据披露。
实体瘤I期研究:截至2024年10月1日,181例实体瘤(80例转移性乳腺癌,37例结直肠癌,23例胃癌,41例其它)患者入组接受治疗,其中41例参加剂量递增研究(1.5-9mg/kg),140例参加剂量扩展研究(6mg/kg或7.5mg/kg)。结果显示,中位随访8.15个月时,未出现DLT,也未达到最大耐受剂量(MTD)。在165例可评估疗效的患者中,ORR为41.2%(均为PR)。此外,7例HER2阳性乳腺癌脑转移患者实现PR,其中1例在接受4个周期治疗后实现完全缓解(CR)。
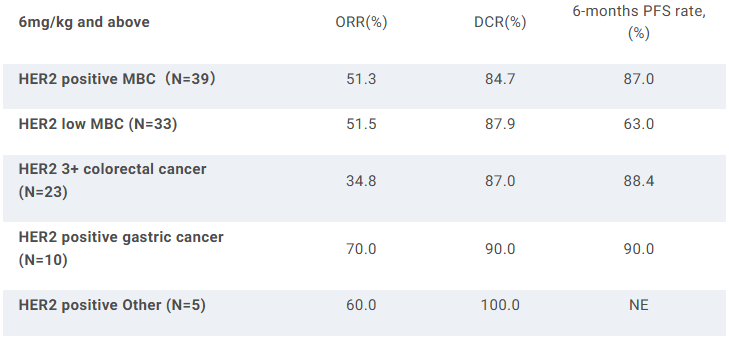
HER2低表达乳腺癌Ib期研究:73例化疗经治患者入组接受单药TQB2102(37例6mg/kg,36例7.5mg/kg)治疗。结果显示,中位随访7.16个月时,总人群ORR为53.4%(39/73),其中6mg/kg剂量组为48.7%,7.5mg/kg剂量组为58.3%;疾病控制率(DCR)为86.3%(63/73)。HR阳性和HR阴性亚组患者的ORR分别为54.0%(27/50)和52.2%(12/23),其中7.5mg/kg剂量组HR阳性和HR阴性亚组患者的ORR分别为66.7%(14/21)和46.7%(7/15)。在接受过ADC治疗的亚组患者中,ORR为44.4%(4/9)。
安全性方面,TRAE发生率为97.3%(71/73),3级及以上TRAE发生率为41.1%(30/73),SAE发生率为17.8%(13/73)。没有患者出现间质性肺炎。
产品:TQB2868
药物靶点 类型:PD-1/TGF-β双抗
公司:正大天晴
全球研发赛道排名:2/7
本次公布的II期研究旨在评估TQB2868联合安罗替尼以及白蛋白结合型紫杉醇和吉西他滨一线治疗转移性胰腺导管腺癌(mPDAC)的有效性和安全性,共纳入40例患者,其中36例患者符合疗效评估条件。
结果显示,中位随访5.9个月时,中位PFS和中位OS尚未达到,6个月PFS率和6个月OS率分别为86%和95%。ORR为63.9%(23/36),其中23例患者达到PR;DCR为100%(36/36)。在探索性分析中,给药后大多数病例中TGF-β1的抑制率超过90%,且几乎没有反弹。
产品:HLX43
药物靶点 类型:PD-L1 ADC
公司:复宏汉霖
全球研发赛道排名:1/5
本次公布的I期研究分为两个部分。第1部分共纳入了18例对标准治疗无效或不适用的晚期/转移性恶性实体瘤患者,包括12例NSCLC、1例头颈部鳞状细胞癌、1例宫颈鳞状细胞癌、1例胸腺鳞状细胞癌、1例鼻咽癌、1例子宫癌肉瘤、1例小细胞肺癌。结果显示,研究者评估的ORR为31.3%。
第2部分纳入了对标准治疗无效的晚期/转移性NSCLC患者,包括15例鳞状NSCLC和6例非鳞状NSCLC。结果显示,研究者评估的ORR和DCR分别为38.1%和81.0%,其中8例患者(6例鳞状NSCLC和2例非鳞状NSCLC)实现PR。结果提示,HLX43在不同剂量下耐受性良好,并在包括NSCLC在内的标准治疗失败的晚期实体瘤患者中展现出初步疗效。
产品:舒瑞基奥仑赛(satri-cel/CT041)
药物靶点 类型:CLDN 18.2 CAR-T疗法
公司:科济药业
全球研发赛道排名:1/34
产品:LBL-024
药物靶点 类型:PDL1/4-1BB 双抗
公司:维立志博
全球研发赛道排名:3/22
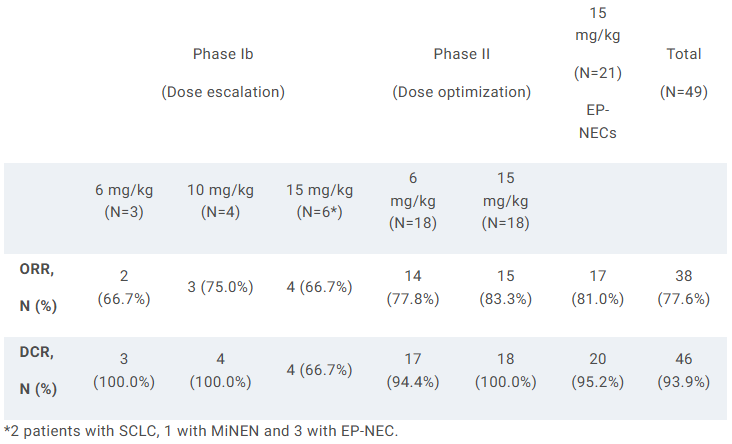
本次公布结果的是一项Ib/II期研究,其中Ib期剂量递增研究纳入既往未治疗的晚期肺外神经内分泌癌(EP-NEC)和小细胞肺癌(SCLC)患者,II期剂量优化/剂量扩展研究纳入既往未治疗的晚期EP-NEC患者。
截至2024年12月26日,53例(Ib期13例,II期40例)患者入组接受治疗。结果显示,在49例可评估疗效的患者中,所有剂量组总ORR为77.6%,DCR为93.9%。在21例EP-NEC患者中,所有剂量组总ORR为81.0%,DCR为95.2%。此外,2例SCLC患者均实现ORR。结果提示LBL-024联合化疗的耐受性良好,在EP-NEC中观察到的疗效显著高于历史报道(约30%-55%)。
产品:芦康沙妥珠单抗
药物靶点 类型:TROP2 ADC
公司:科伦博泰
全球研发赛道排名:2/57
本次ASCO大会,芦康沙妥珠单抗有4项临床研究成果入选,选取其中2项进行介绍。
III期OptiTROP-Lung03研究共纳入137例经EGFR-TKI治疗及铂类化疗后进展的晚期EGFR突变NSCLC患者。结果显示,中位随访12.2个月时,芦康沙妥珠单抗组BIRC评估的cORR高于多西他赛组(45.1% vs 15.6%,单侧p=0.0004);BIRC评估的中位PFS显著延长(6.9个月 vs 2.8个月,HR=0.30,单侧p<0.0001),研究者评估的中位PFS分别为7.9个月和2.8个月(HR=0.23)。由于多西他赛组中有36.4%的患者交叉接受了芦康沙妥珠单抗治疗,两组的中位OS均尚未达到(HR=0.49,单侧p=0.007)。对于因交叉给药而调整的中位OS,经预设的保秩结构失效时间(RPSFT)模型分析,多西他赛组为9.3个月,芦康沙妥珠单抗组尚未达到(HR=0.36)。
II期OptiTROP-Breast05研究共纳入41例既往未接受过治疗的不可切除的局部晚期或转移性三阴性乳腺癌(a/m TNBC)患者(其中43.9%的ECOG PS评分为1分;78.0%的PD-L1 CPS<10)。结果显示,中位随访18.6个月时,ORR为70.7%,DCR为92.7%,DoR为12.2个月,中位PFS为13.4个月。在PD-L1 CPS<10的32例患者中,ORR为71.9%,DCR为93.8%,中位PFS为13.1个月。
产品:ZG006
药物靶点 类型:CD3/DLL3三抗
公司:泽璟制药
全球研发赛道排名:1/1
这项II期研究评估了ZG006单药(10mg或30mg,每2周1次)治疗既往接受过至少二线标准系统治疗的小细胞肺癌(SCLC)患者的疗效。
截至2024年12月31日,40例患者入组,其中27例可评估疗效。结果显示,18例患者实现PR(其中5例已确认,其余待确认),总体ORR为66.7%(18/27),DCR为92.6%。10mg剂量组和30mg剂量组ORR分别为53.8%(7/13)和78.6%(11/14),DCR分别为84.6%(11/13)和100.0%(14/14)。DoR和PFS数据尚未成熟,需进一步随访更新。此外,在21例(77.8%)DLL3低表达(17例)或DLL3中表达(4例)患者中,ZG006抗肿瘤疗效显著,15例患者达到PR,ORR为71.4%。
安全性方面,TRAE发生率为87.5%(35/40),3级及以上TRAE发生率为12.5%(5/40),SAE发生率为12.5%(5/40),没有患者因TRAE停药或死亡。
产品:SHR-1501
药物靶点 类型:IL-15-Fc融合蛋白
公司:恒瑞医药
全球研发赛道排名:1/6
卡介苗(BCG)是经尿道膀胱肿瘤切除术后治疗高危非肌层浸润性膀胱癌(NMIBC)的标准疗法。本次公布结果的I/II期研究评估了SHR-1501在高危NMIBC患者中的安全性、耐受性和疗效。I期研究分为Ia期剂量递增部分(单药SHR-1501,n=8)和Ib期(SHR-1501 BCG,n=6)部分;II期研究评估SHR-1501(600μg) BCG,分为队列A(BCG初治NMIBC,n=29)、队列B(BCG无应答的原位癌,n=17)、队列C(BCG无应答的非原位癌高级别Ta/T1期NMIBC,n=24)。
结果显示,I期研究未出现DLT,也未达到MTD。队列B可评估疗效患者的3个月或6个月CR率为90.9%(10/11);队列A和队列C的12个月无疾病生存期(DFS)率尚未达到,9个月DFS率分别为94.4%和53.9%。
安全性方面,单药组和SHR-1501 BCG组的TRAE发生率分别为50.0%(4/8)和69.7%(53/76),3级及以上TRAE发生率分别为12.5%(1/8)和9.2%(7/76),没有患者出现4-5级TRAE,也没有患者出现SAE。



 VIP复盘网
VIP复盘网
