
1. URAT1抑制剂国内陆续读出重磅数据,恒瑞实现国内报产
创新药领域:百利天恒、信达生物、三生国健、奥赛康、百济神州、海思科、和黄医药、亚盛医药、迪哲医药、迈威生物、泽璟制药-U、恒瑞医药等;
中药领域:佐力药业、方盛制药、江中药业、华润三九、济川药业、马应龙等;
CXO及科研服务领域:药明康德、药明合联、康龙化成、凯莱英等;
仿创药领域:人福医药、恩华药业、仙琚制药、苑东生物、信立泰等;
2. 高尿酸血症和痛风的基本特征
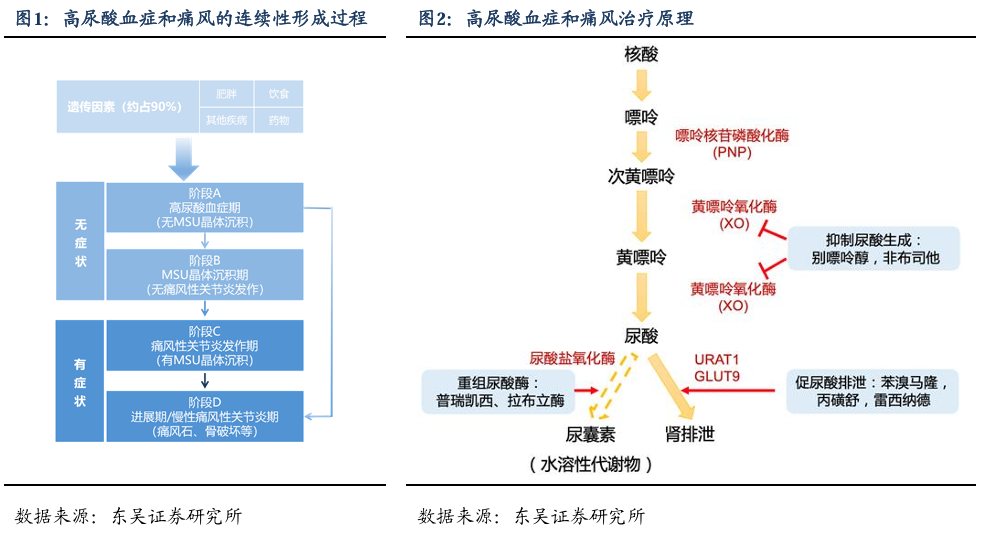
高尿酸血症是由于血液中尿酸水平过高而引起的一种代谢性疾病,通常会导致痛风、尿酸肾病等疾病,且极易引起包括高血压、脂肪肝、慢性肾病和心脑血管等并发症。痛风与嘌呤代谢紊乱及高尿酸血症直接相关,其会在关节腔等处形成尿酸盐沉积,进而引发急性关节疼痛。痛风是由单钠尿酸盐沉积所致的晶体相关性关节病,属代谢性风湿病范畴。高尿酸血症和痛风是一个连续、慢性的病理过程,需要长期、甚至是终生的病情监测与管理。
2.1. 高尿酸血症及痛风患病人群较高,市场空间大
中国高尿酸血症的总体患病率达13.3%,其中男性为18.5%,女性为8.0%,据人口普查数据计算,我国高尿酸血症患者规模达1.88-2.96亿。中国痛风总体发病率达1.1%,根据人口普查数据计算,我国痛风患者每年新发1552-7058万。欧洲及北美地区高尿酸血症患病率介于2%-18%。
痛风发病率持续上升,治疗达标率低。尿酸水平增加直接导致了痛风患病风险的上升,且痛风与生活方式密切相关,超过50%的痛风患者超重或肥胖,嘌呤、乙醇和果糖过量摄入亦会增加痛风发病风险。18-35岁的年轻高尿酸血症及痛风患者占比近60%,呈现年轻化趋势。我国高尿酸血症患者的治疗率较低,这主要是由于医生和患者均未认识到其危害性;痛风治疗率虽然较高,但由于治疗不规范,国内外整体痛风治疗的效果均不佳,中国的达标率仅10%。
2.2. URAT1靶点在高尿酸血症治疗中起到关键的作用
高尿酸血症与痛风的形成过程是,在体液的pH条件下,尿酸以其离子型态尿酸盐形式存在。人体的尿酸盐含量由饮食摄入的嘌呤量、人体尿酸盐合成量以及尿酸盐从尿液、消化系统排出量的平衡决定。体内尿酸合成过剩和尿酸排泄障碍是高尿酸血症和痛风的发病机理,所以对体内尿酸稳态的控制是治疗高尿酸血症和痛风的关键。
急性痛风发作可以用非甾体类抗炎药(NSAID)、秋水仙碱或皮质类固醇(关节内注射或全身注射)来控制。这三种药物均适合作为急性痛风的一线治疗药物,作用是消炎镇痛。应在发病后24小时内开始治疗。药物的选择取决于患者对这些药物的耐受性以及是否存在任何禁忌使用特定药物的合并症。
主要治疗目标是将尿酸盐水平降低至6.8mg/dL以下。目前降尿酸药物主要有三大类:减少尿酸盐的产生(黄嘌呤氧化酶抑制剂):如别嘌醇、非布司他等;增强尿酸(排尿酸剂)的尿液排泄:如苯溴马隆、丙磺舒等;促进尿酸分解药物—尿酸酶类:如普瑞凯西、拉布立酶等(仅在国外用)。用降尿酸药治疗通常是终生的。因此,药物的安全性和患者的依从性至关重要。
2.3. 中国及全球高尿酸血症及痛风治疗现状
ACR指南建议在有效抗炎治疗基础上,痛风发作急性期可开始降尿酸治疗,但需小剂量开始并警惕不良反应;中国指南则建议痛风急性发作完全缓解后2-4周开始。ACR指南不推荐进行降尿酸治疗;中国指南指出血尿酸水平≥540μmol/L或血尿酸水平≥480μmol/L且有合并症(如高血压等)时开始治疗。ACR指南未对难治性痛风进行明确定义和推荐,称国际上缺乏共识;中国指南给出了难治性痛风的定义,即具备单用或联用常规降尿酸药物足量、足疗程但血尿酸仍≥360μmol/L等条件。二者均强烈建议选择低剂量秋水仙碱进行治疗,且中国指南还指出小剂量治疗痛风同样有效且不良反应明显减少。

2.4. 中国及全球高尿酸血症及痛风药物研发现状
2.4.1. 目前全球已经上市的治疗高尿酸血症的药物
现有上市药物作用机制涵盖URAT1抑制剂(苯溴马隆、雷西纳德、多替拉德)、XO抑制剂(别嘌醇、非布司他、托匹司他)、、GLUT9抑制剂(苯溴马隆)以及重组UO(拉布立酶、普瑞凯希)等,为不同类型高尿酸血症患者提供了多样化的治疗靶点和选择。目前全球已上市的治疗高尿酸血症药物各有特点,药物研发呈现多样化和全球化的趋势,临床应用需综合多因素选择,未来有望有更多更优的药物问世以满足患者需求。
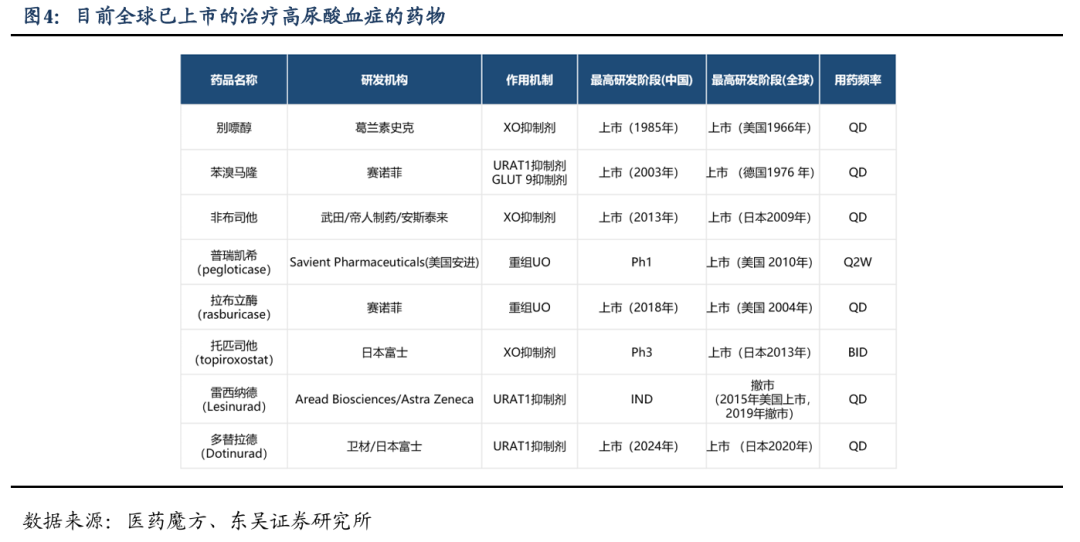
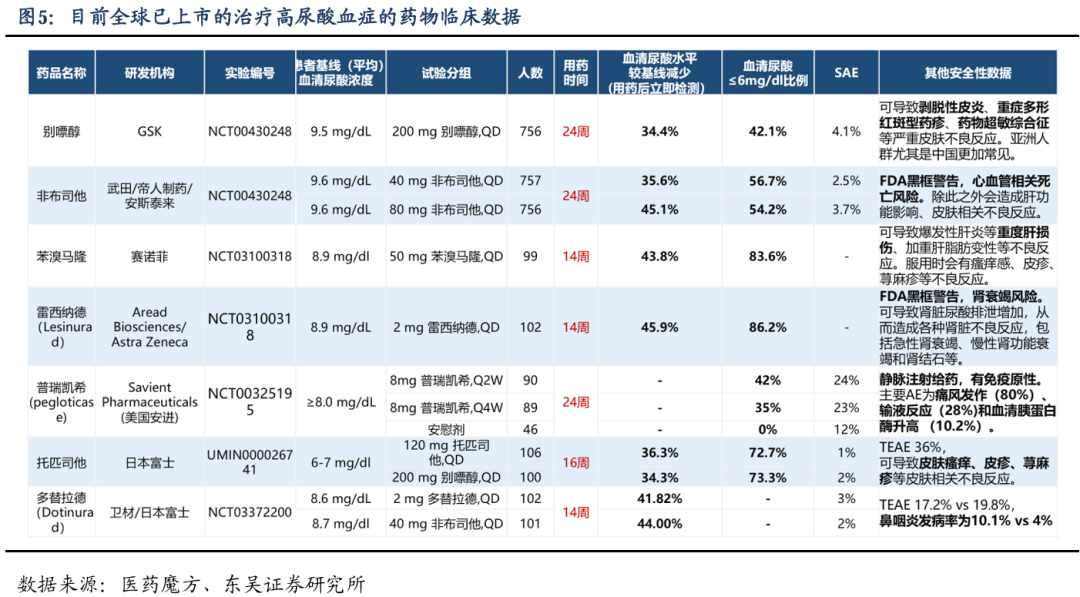
在治疗高尿酸血症的药物研究中,药物的安全性是评估其临床应用潜力的重要方面。根据提供的数据,多种药物在降低血清尿酸水平方面显示出了显著效果,但同时也伴随着不同程度的安全性问题。例如,别嘌醇虽然能有效降低血清尿酸水平,但存在导致剥脱性皮炎、重症多形红斑型药疹、药物超敏综合征等严重皮肤不良反应的风险,尤其在亚洲人群中更为常见。非布司他则被FDA黑框警告,指出其可能增加心血管死亡风险,并可能影响肝功能及引起皮肤不良反应。苯溴马隆可能导致爆发性肝炎等重度肝损伤,以及瘙痒感、皮疹、荨麻疹等皮肤问题。雷西纳德则有肾衰竭风险,可能引起肾脏尿酸排泄增加,导致急性肾衰竭、慢性肾功能衰竭和肾结石等不良反应。普瑞凯希的静脉注射给药方式具有免疫原性,主要不良事件包括痛风发作、输液反应和血清胰蛋白酶升高。托匹司他和多替拉德虽然在降低血清尿酸方面效果显著,但也存在皮肤瘙痒、皮疹、荨麻疹等皮肤相关不良反应,以及鼻咽炎发病率的增加。这些数据强调了在药物研发过程中,除了疗效外,安全性评估同样至关重要,以确保药物的临床应用既能有效治疗疾病,又能最小化对患者的潜在风险。
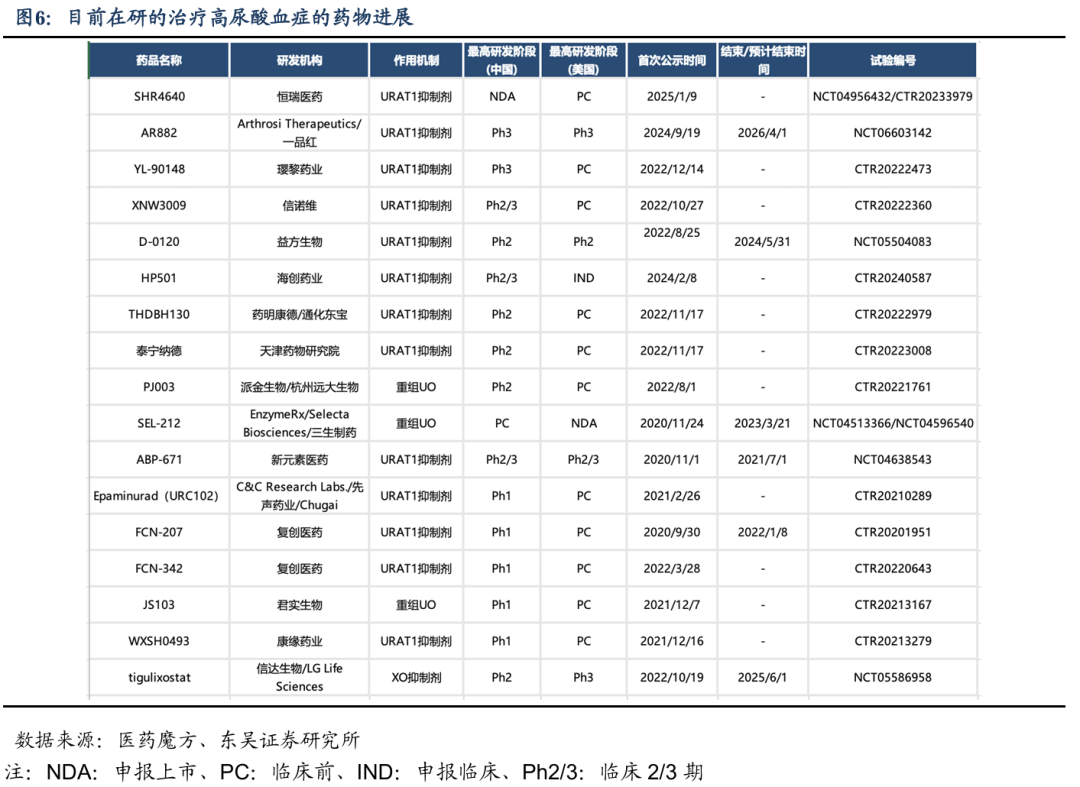
2.4.1. 目前在研的治疗高尿酸血症的药物进展
在治疗高尿酸血症的药物研发领域,URAT1是肾脏中尿酸重吸收的重要转运蛋白,在维持体内尿酸平衡中起着关键作用。抑制URAT1能够直接干预尿酸的排泄过程,相较于其他作用机制,这种对尿酸排泄的直接调控可能被认为是一种更具针对性和潜力的治疗策略,因此吸引了众多药企投入研发,导致URAT1抑制剂在高尿酸血症治疗药物研发中占比较高。根据最新的研究进展,多个URAT1抑制剂已经进入不同的临床试验阶段。例如,由恒瑞医药研发的SHR4640已经在中国提交了上市申请,目前国内进展最快,并在美国进入临床前阶段;一品红的AR882美国进入了III期临床,海外进展最快;璎黎药业的YL-90148处于中国和美国的III期临床试验阶段;信诺维的XNW3009同样处于II/III期临床试验阶段;新元素医药的ABP-671处于II/III期临床试验阶段。
众多URAT1抑制剂在治疗高尿酸血症方面的临床研究正在积极推进,多个药物已经进入后期临床试验阶段。新型URAT1抑制剂有望克服现有治疗手段的不足,为高尿酸血症患者带来更好的治疗选择和预后。根据历史数据肩对肩比较,相比已上市药物,这些在研品种降尿酸效果(有效性)好于已上市药物,尤其是安全性数据突出,解决了已上市药物耐受性和肝肾毒等安全性问题。
恒瑞医药的SHR4640产品是国内进展最快的URAT1抑制剂,2025年1月在中国已递交了上市申请,预计2025年年底国内获批上市。2024 年 8 月,SHR4640 治疗原发性痛风伴高尿酸血症受试者的Ⅲ期临床试验(SHR4640-303)研究完成且主要研究终点达到方案预设的优效标准。与别嘌醇相比,SHR4640对原发性痛风伴高尿酸血症有统计学显著性和临床意义更优效的改善。同时,SHR4640的安全性、耐受性良好。
SHR4640后续也开展了多项联合用药探索。2024年6月欧洲风湿病学大会(EULAR年会)上报道了经非布司他治疗未达标的原发性痛风伴高尿酸血症患者中,SHR4640联用SHR4640可以较安慰剂显著提高血尿酸达标率,降低血尿酸水平,且SHR4640 非布司他组整体不良事件发生率与安慰剂 非布司他组相似。
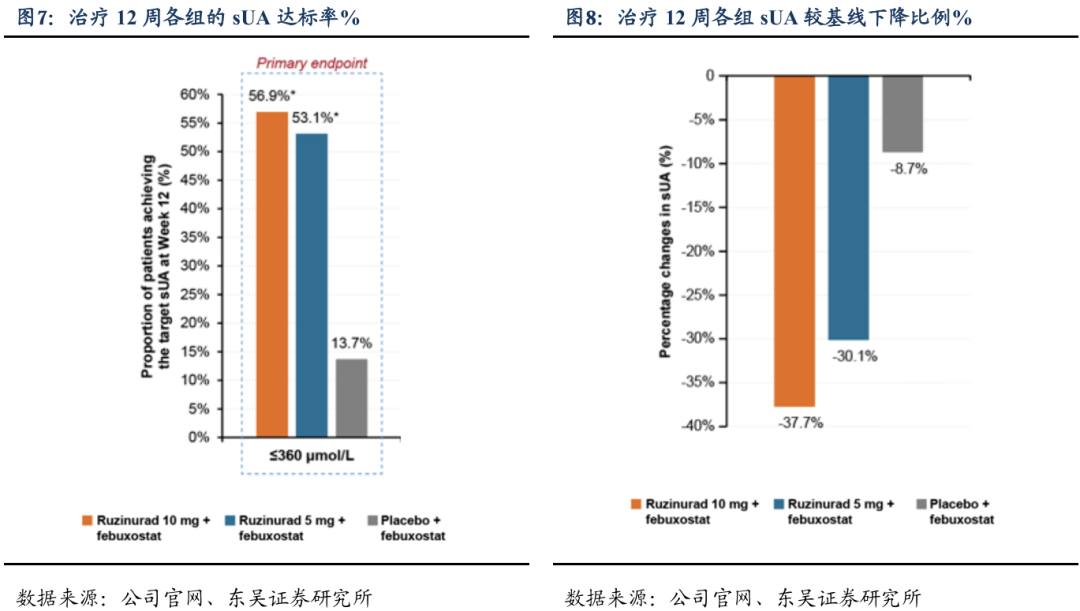
本研究共纳入151例受试者,所有受试者均接受了研究药物治疗,共143例受试者完成12周治疗。有效性方面:治疗12周血清尿酸(sUA)达标(≤360μmol/L)的受试者百分比,SHR4640 10 mg 非布司他组为56.9%,SHR4640 5 mg 非布司他为53.1%,均显著优于安慰剂 非布司他组13.7%(P值均<0.0001);治疗12周血尿酸较基线下降比例:SHR4640 10mg 非布司他组、SHR4640 5mg 非布司他组均明显优于安慰剂组(-37.7% vs -30.1% vs -8.7%)。
一品红的AR882目前是美国临床进展最快URAT1抑制剂,目前在全球多中心III期临床进展中,已获得FDA快速通道资格,预计2026年完成。国内联合非布司他的注册III 期临床也在进行中,预计2026年完成。
在第26届亚太风湿病学会联盟大会上展示了AR882二期临床项目的积极数据:AR882在降低血清尿酸(sUA)水平和消除尿酸晶体沉积方面对亚太地区的痛风患者是安全且有效的。值得注意的是,83%的接受75mg AR882治疗的患者sUA水平降至5 mg/dL以下。研究还表明,AR882单药治疗或与别嘌醇联合使用的效果优于单独使用别嘌醇。AR882耐受性良好,报告的痛风发作次数少于对照组。
另外一项II/III期临床试验,对照药品为非布司他。主要终点指标为治疗8周时血清尿酸<360μmol/L的受试者百分比。AR882在治疗6周时就体现出了卓越的有效性,75mg AR882相对非布司他已体现出了优效(P<0.001)。同时AR882表现出良好的耐受性,无任何重度不良反应发生。临床中观察到的轻中度不良反应包括腹泻、头疼、上呼吸道感染。
3. 研发进展与企业动态
3.1. 创新药/改良药研发进展(获批上市/申报上市/获批临床)
1月9日,恒瑞抗痛风新药申报上市,国家药品监督管理局(NMPA)药品审评中心(CDE)官网显示,恒瑞的URAT1抑制剂SHR4640上市申请已获受理,根据既往的临床研究结果推测适应症为高尿酸血症。
1月8日,PD-1 ADC组合疗法在华获批上市,一线治疗尿路上皮癌。国家药监局官网显示,维恩妥尤单抗(enfortumab vedotin) 帕博利珠单抗(K药)组合疗法在华获批上市,适应症为一线治疗既往未经治疗的局部晚期或转移性尿路上皮癌(la/mUC)成年患者。中国la/mUC患者终于迎来了含铂化疗之外的一线治疗选择。
1月8日,默沙东HPV疫苗获批男性群体,默沙东宣布,佳达修[Gardasil,四价人乳头瘤病毒疫苗(酿酒酵母)]的多项新适应证已获得国家药品监督管理局的上市批准,适用于9~26岁男性接种。新适应证的获批,标志着佳达修成为中国境内首个且目前唯一获批、可适用于男性的HPV疫苗。
1月8日,天境生物CD38单抗申报上市。CDE官网显示,天境生物(TJ Bio)CD38单抗菲泽妥单抗的上市申请已获受理,推测此次申报适应症为多发性骨髓瘤。
1月7日,兆科眼科儿童近视眼药水申报上市,贝伐珠单抗眼科制剂III期研究成功。兆科眼科宣布其眼科产品NVK002(0.01%低浓度阿托品)用于延缓儿童近视加深的上市申请已获国家药监局受理。根据CDE网站受理记录,该申请的受理号应为CYHS2500031。此外,兆科眼科在同日宣布TAB014(贝伐珠单抗)治疗湿性年龄相关性黄斑变性的III期研究也已顺利达到主要终点。
1月5日,GSK超长效IL-5单抗在华申报又一适应症。CDE网站显示,葛兰素史克(GSK)的德莫奇单抗(depemokimab)的新适应症上市申请获得受理。根据临床试验进展,推测此次申报的新适应症为慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)。

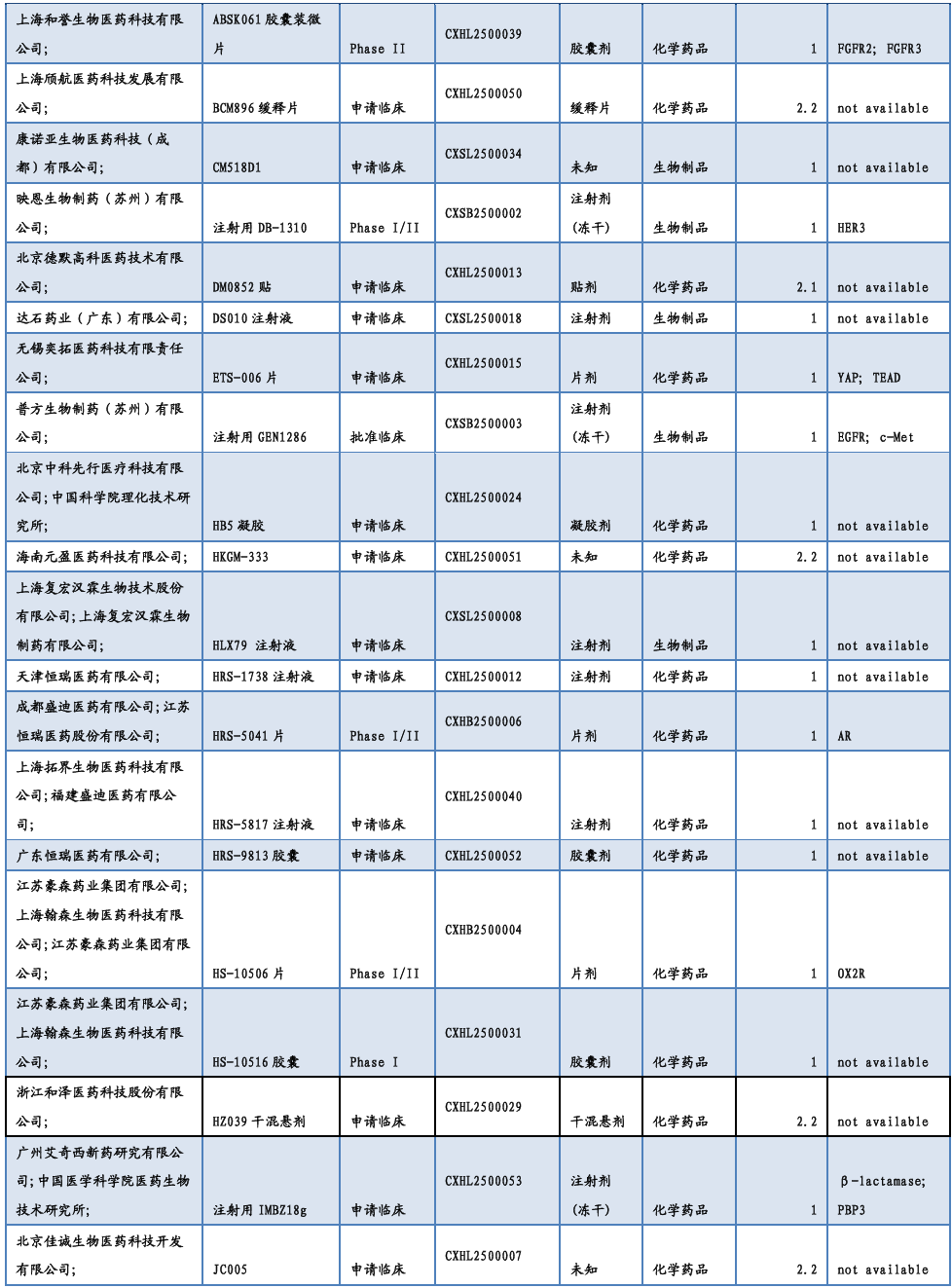
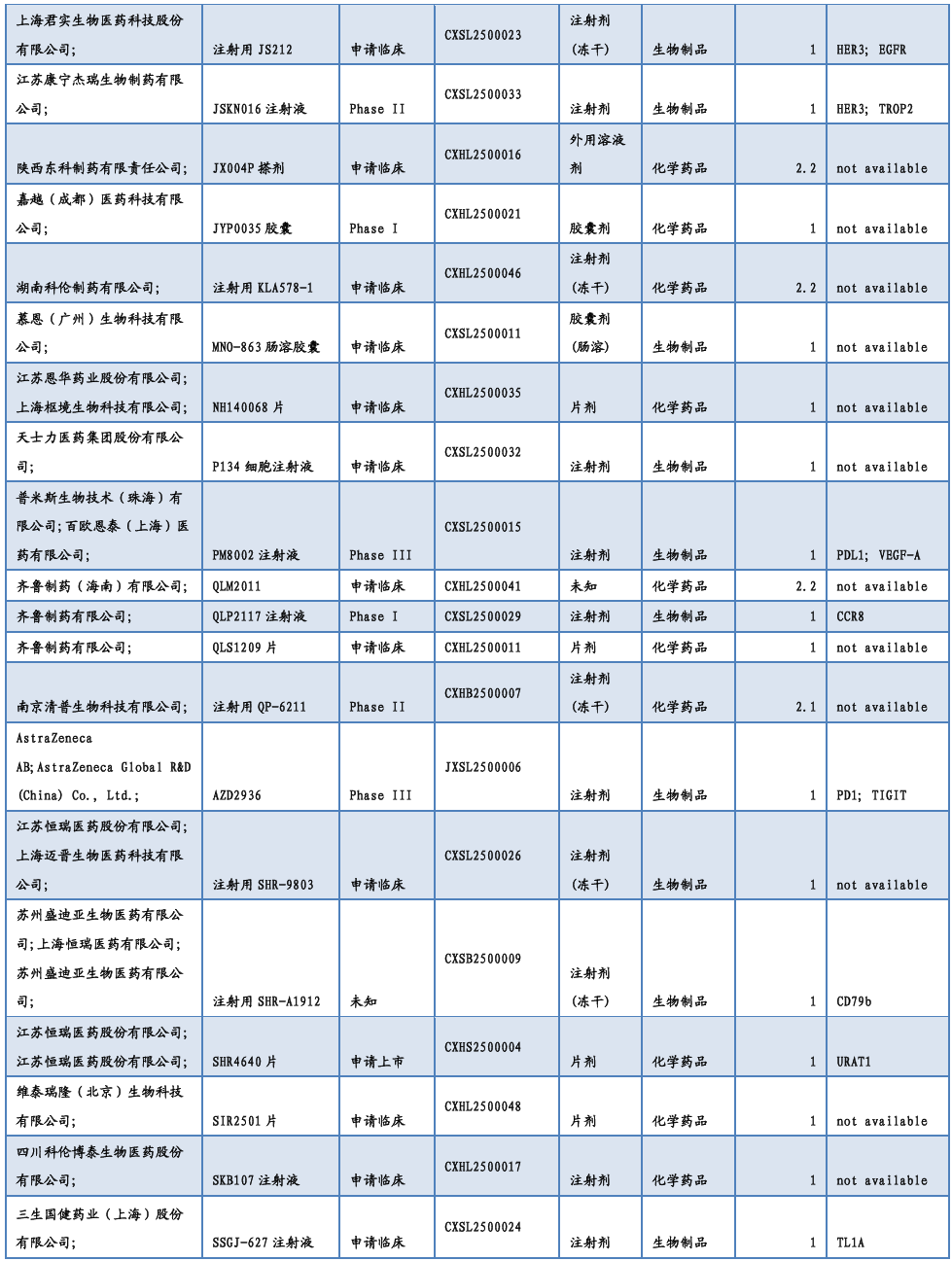
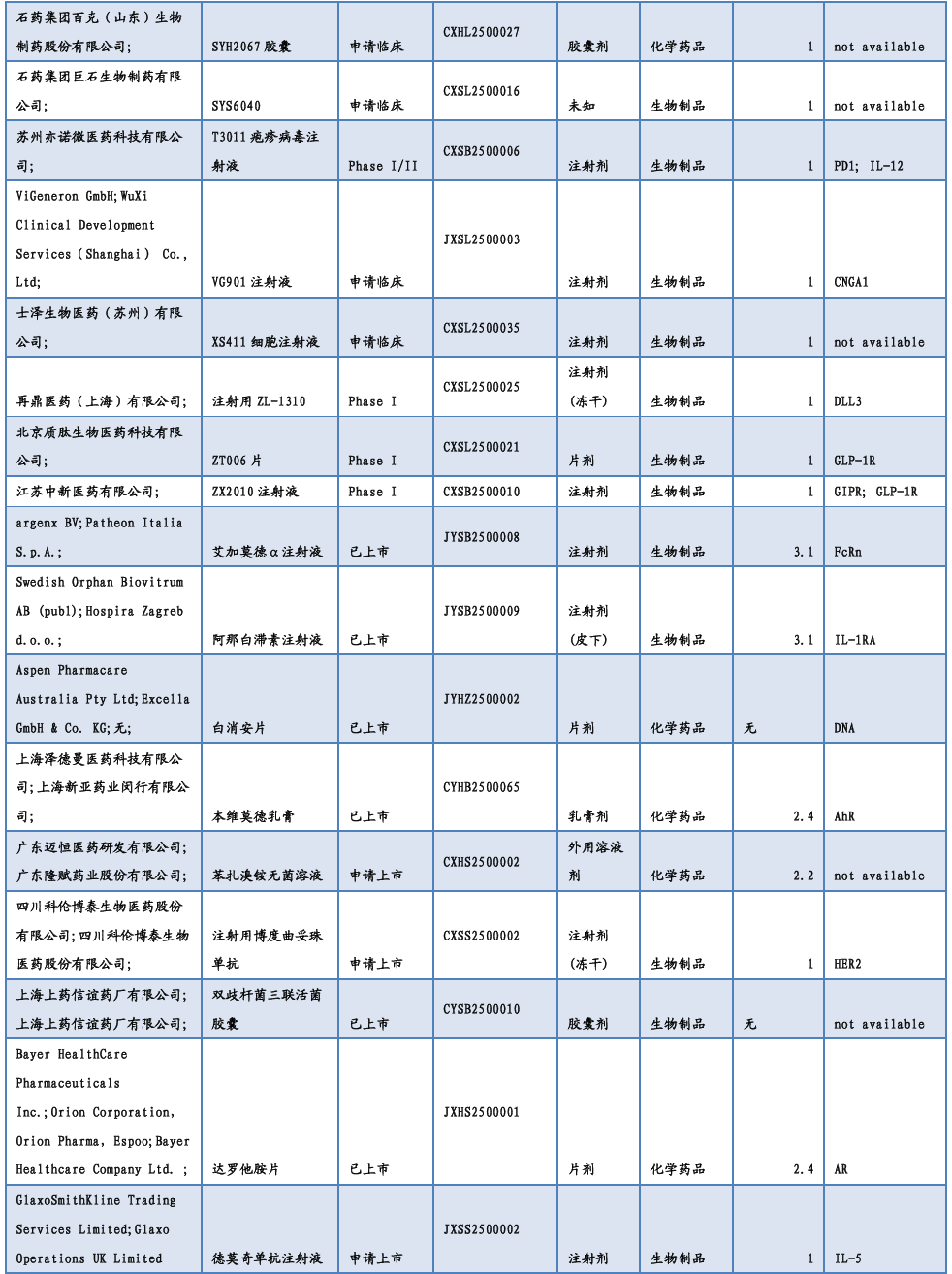
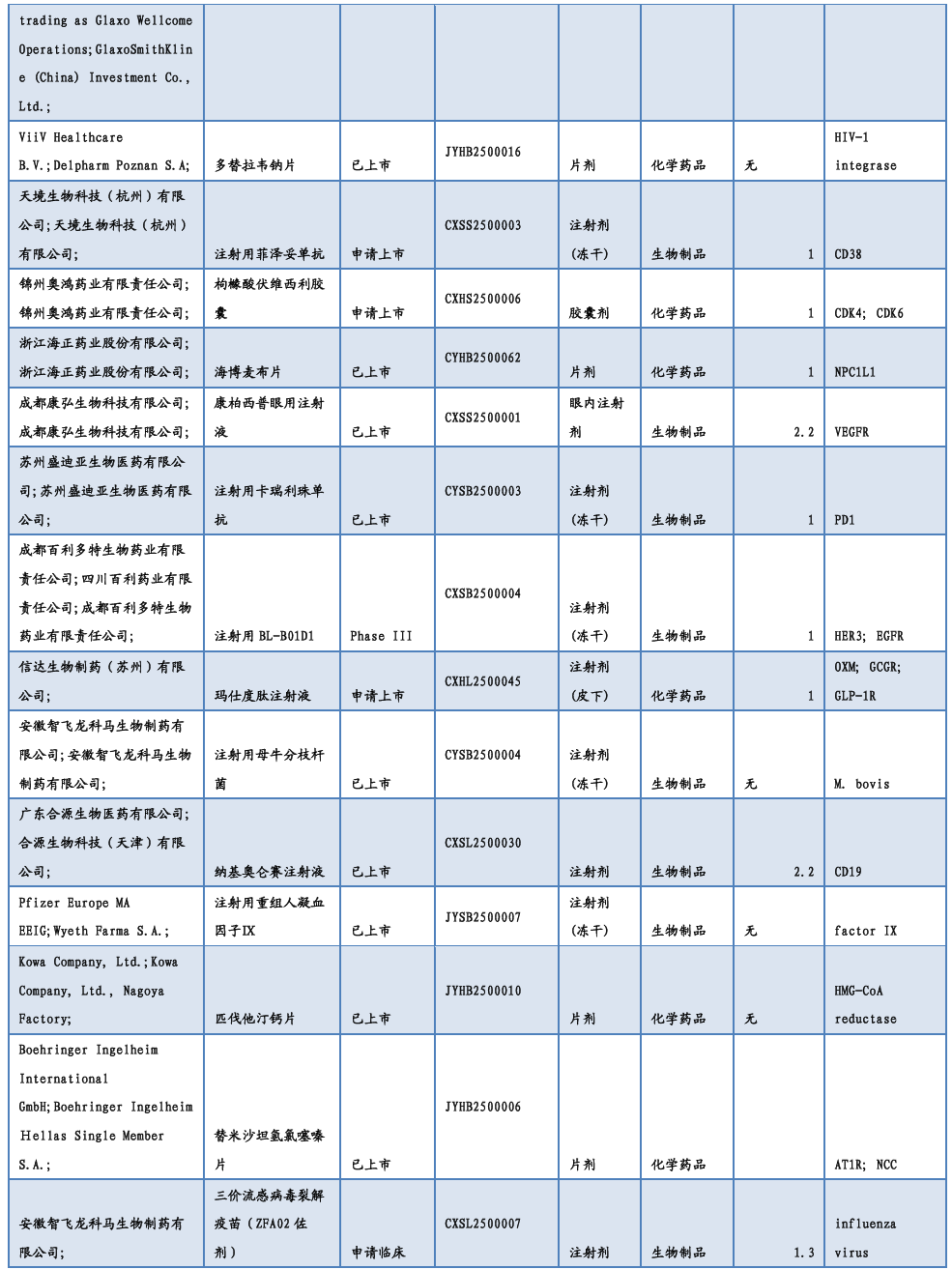

3.2. 仿制药及生物类似物上市、临床申报情况
1月8日,齐鲁制药「伊布替尼片」仿制药获批。国家药监局官网显示,齐鲁制药的伊布替尼片仿制药获批。这是国内首款获批的伊布替尼片剂仿制药。
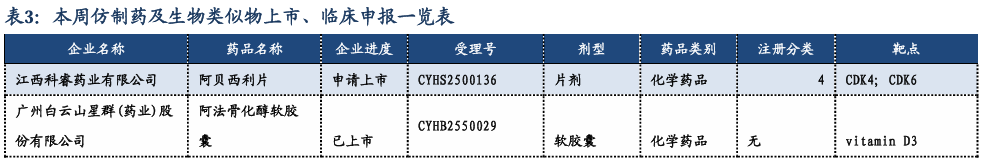
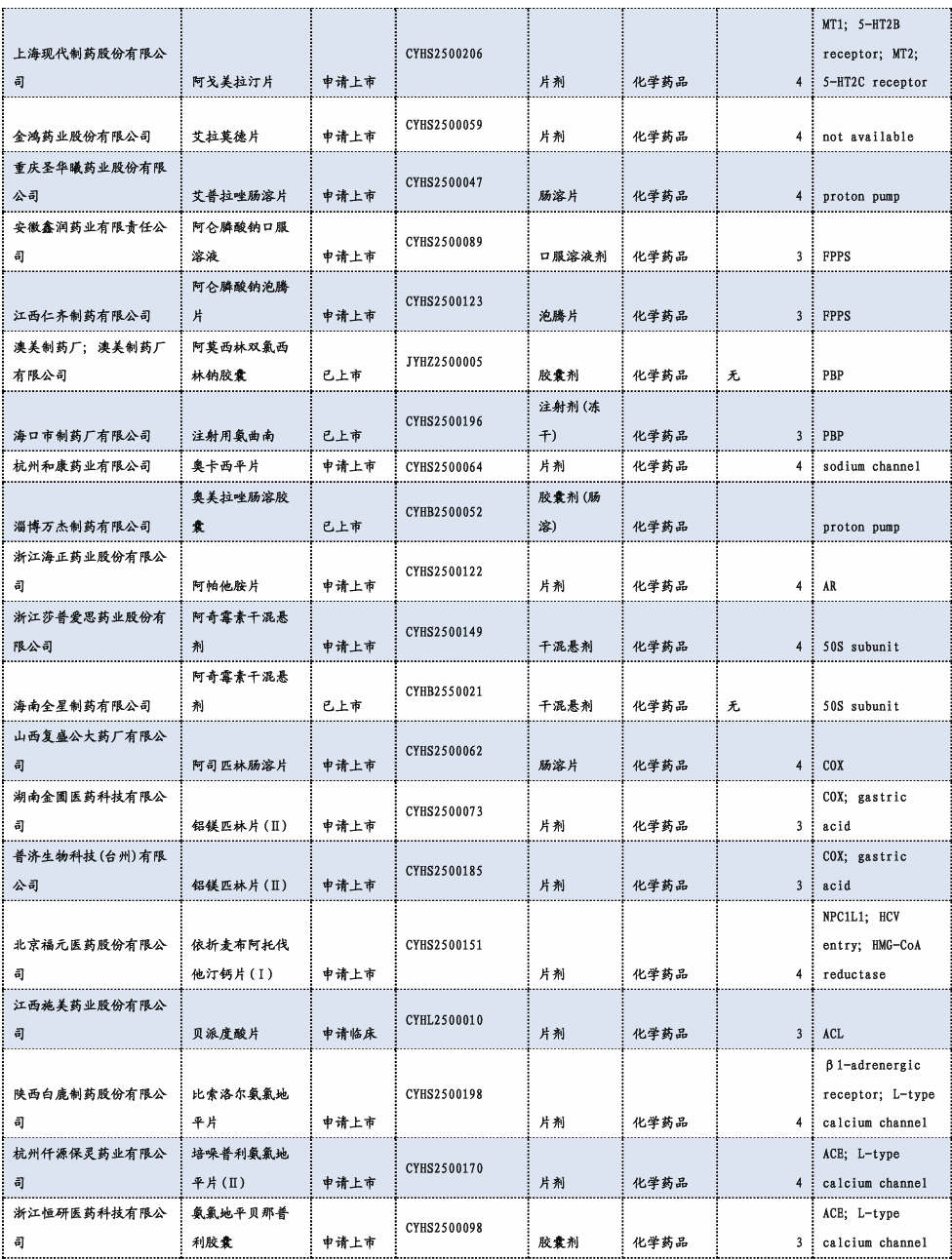
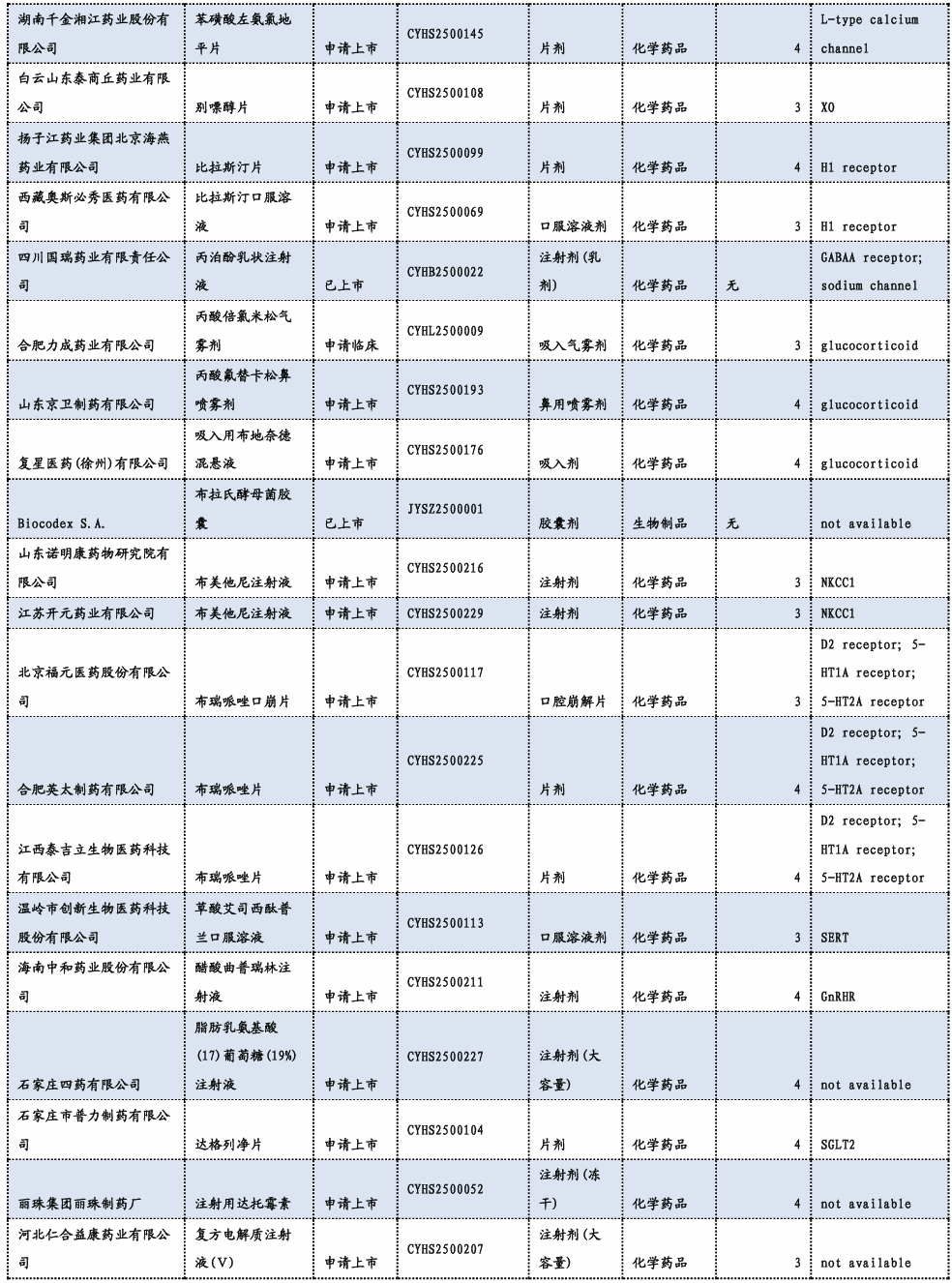
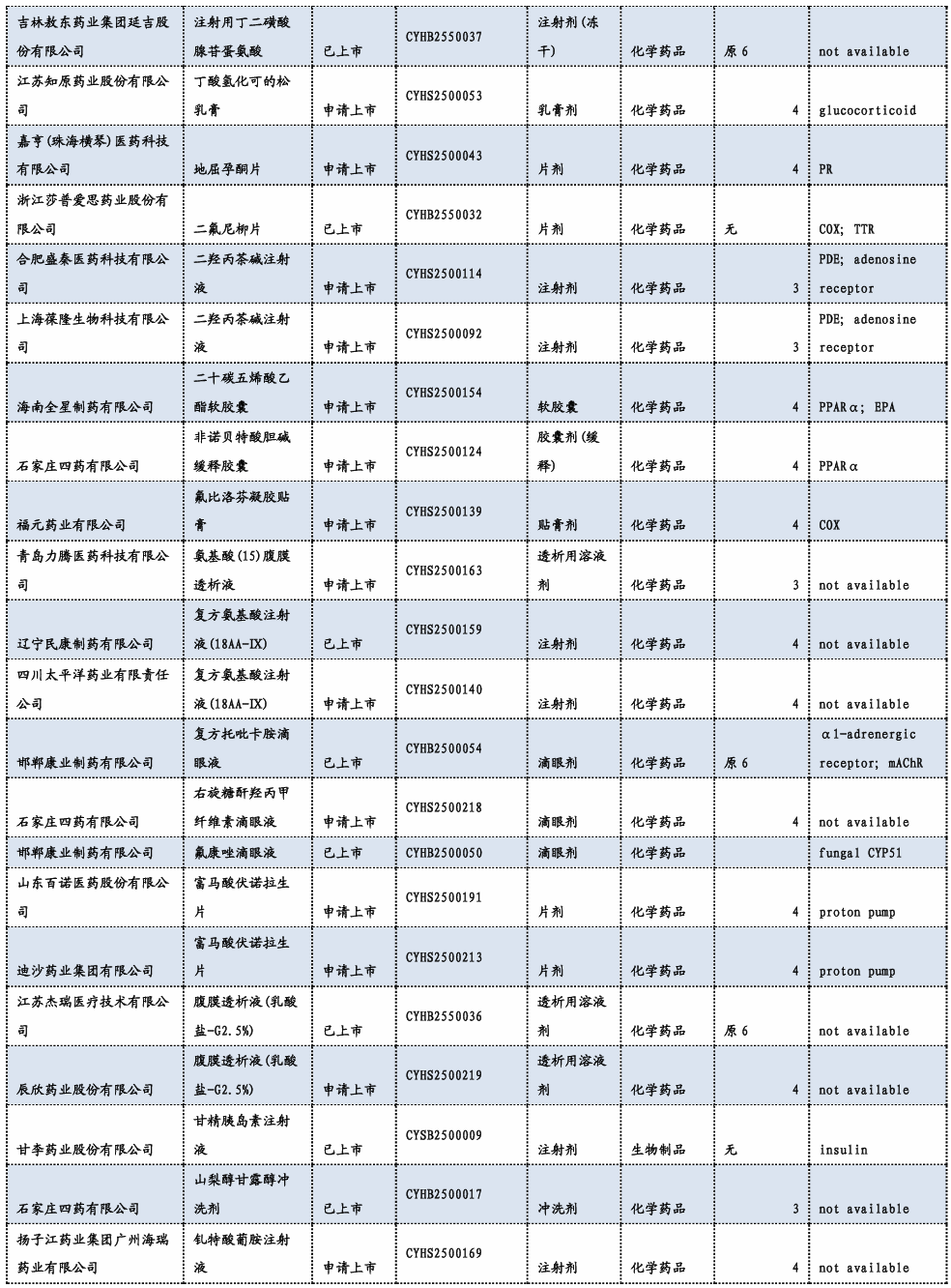
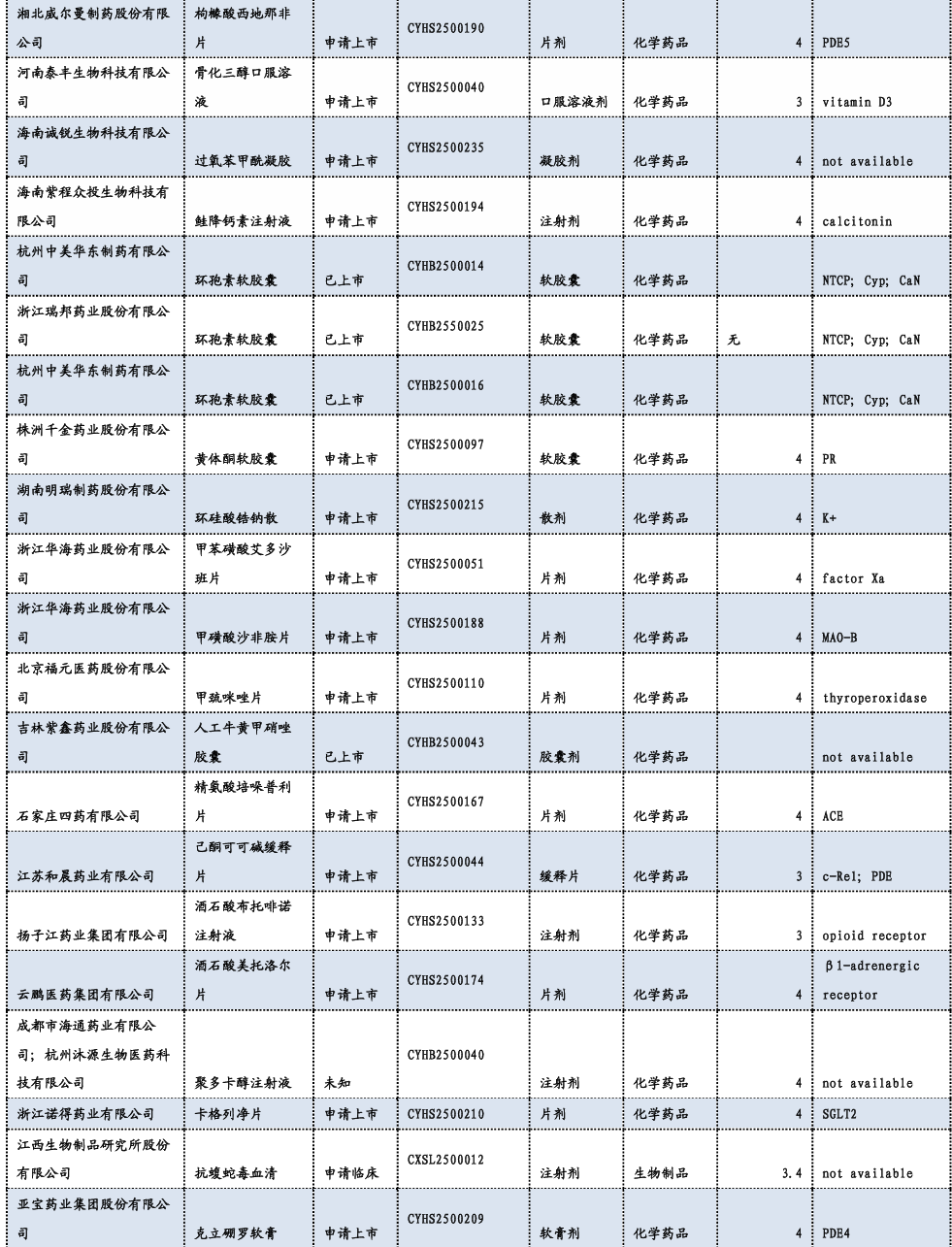
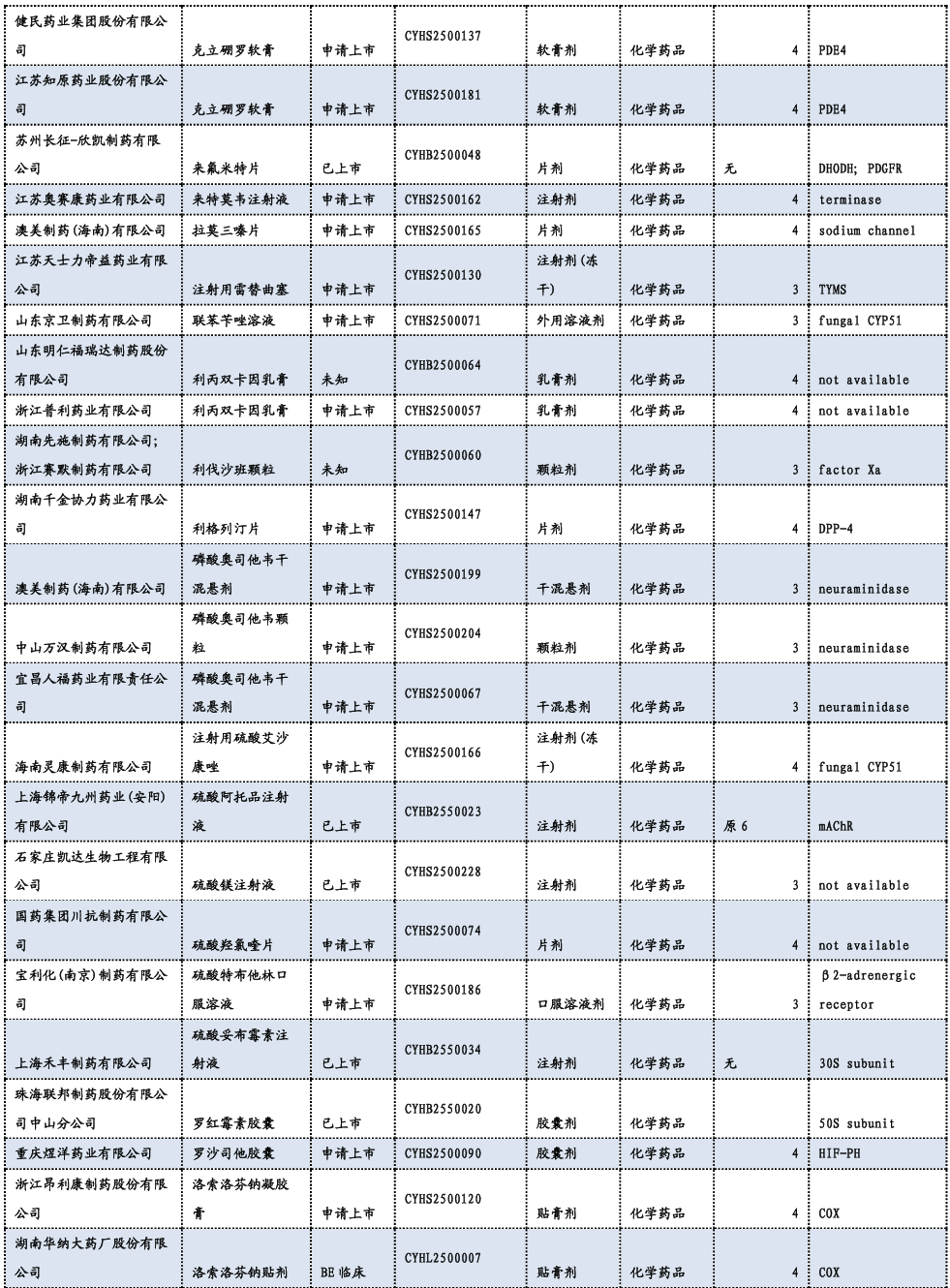
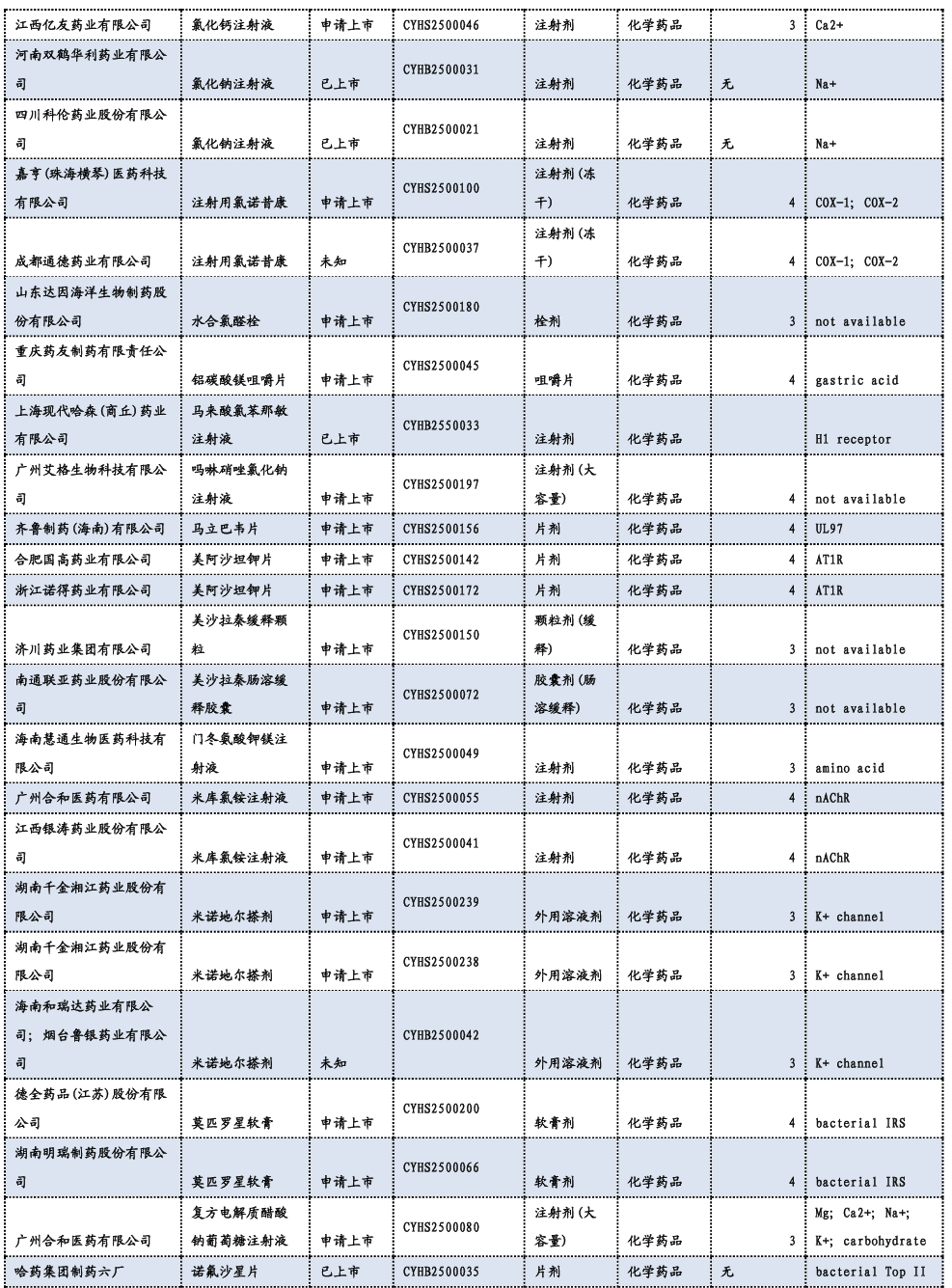
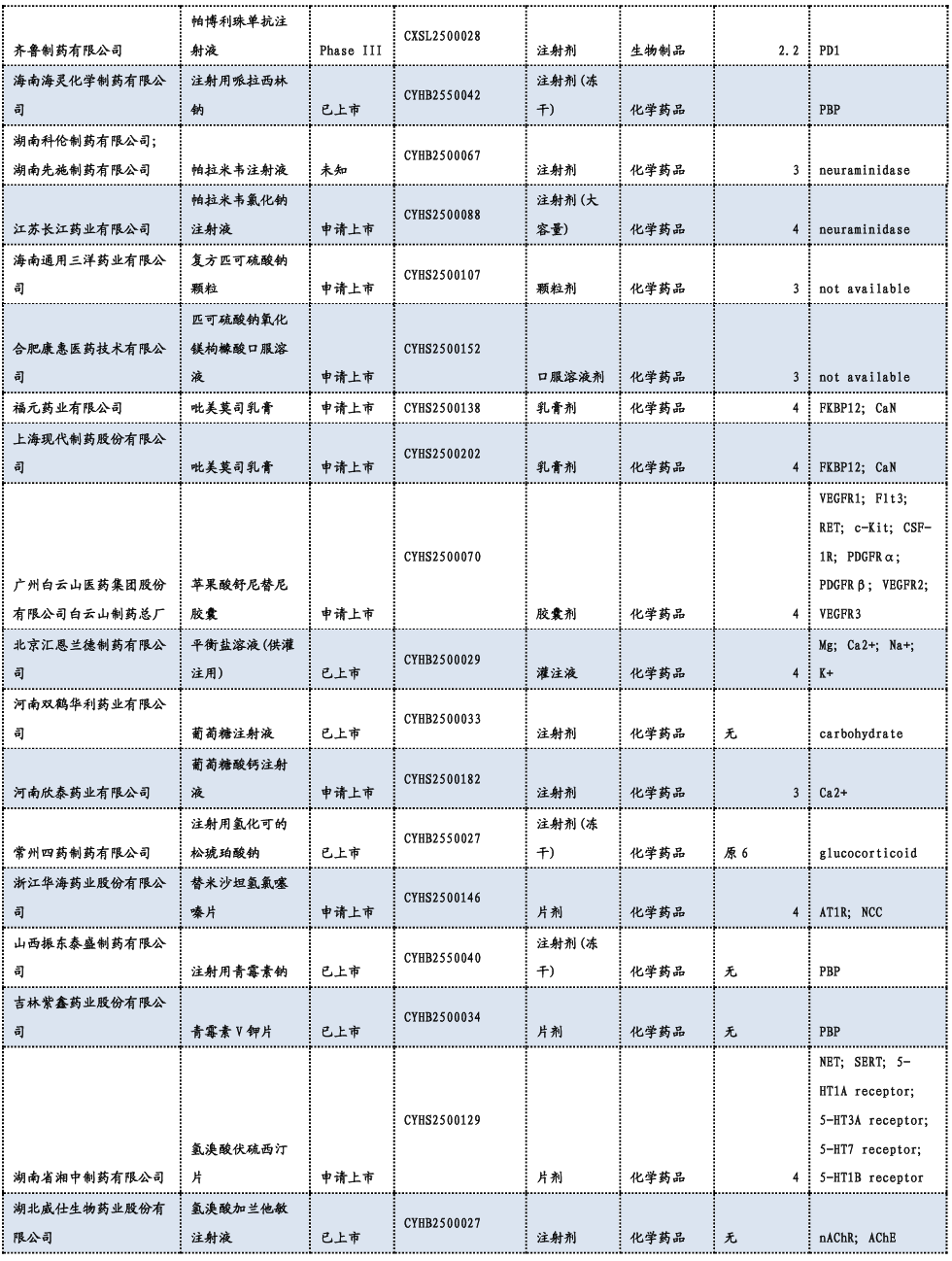
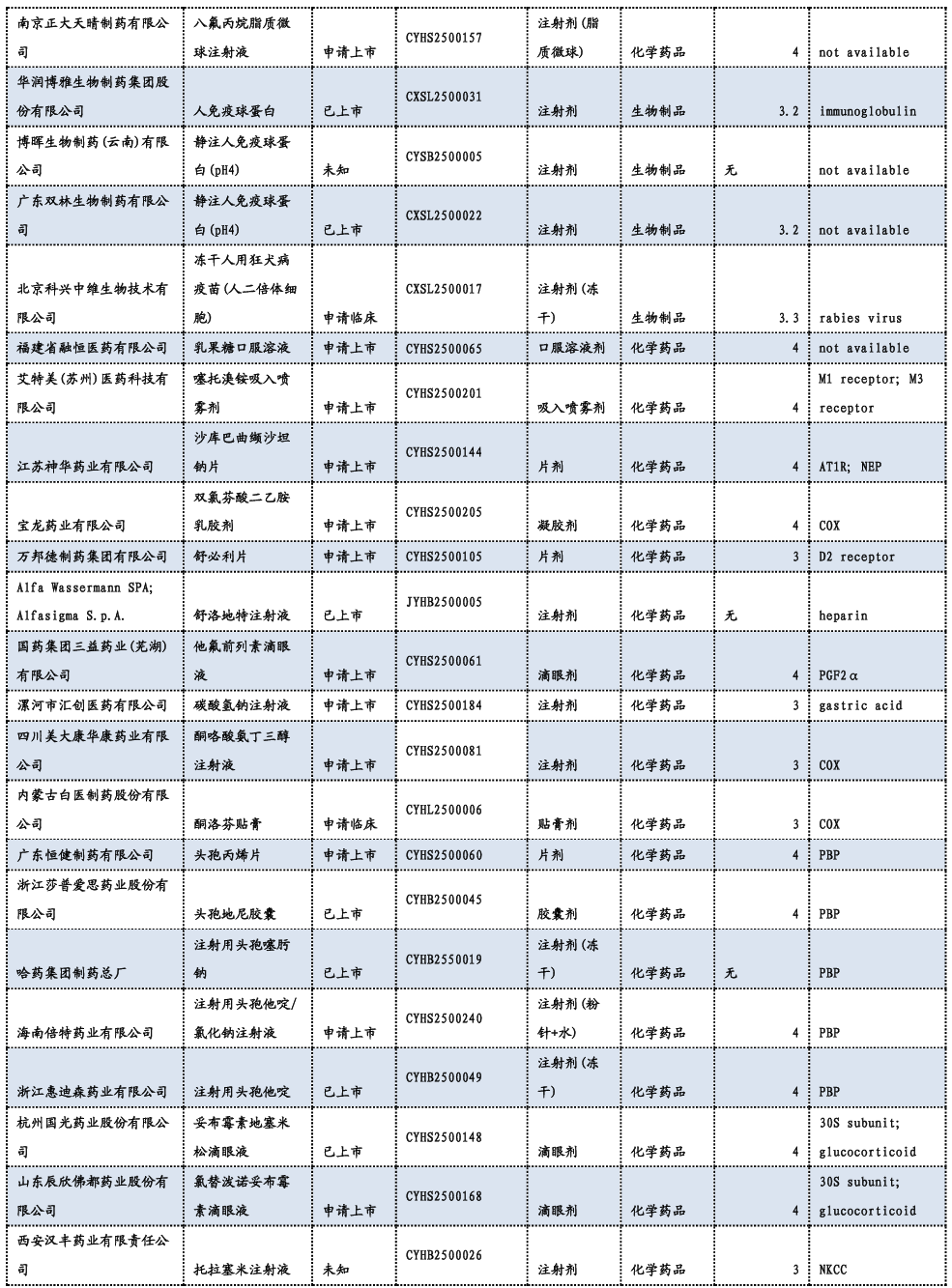
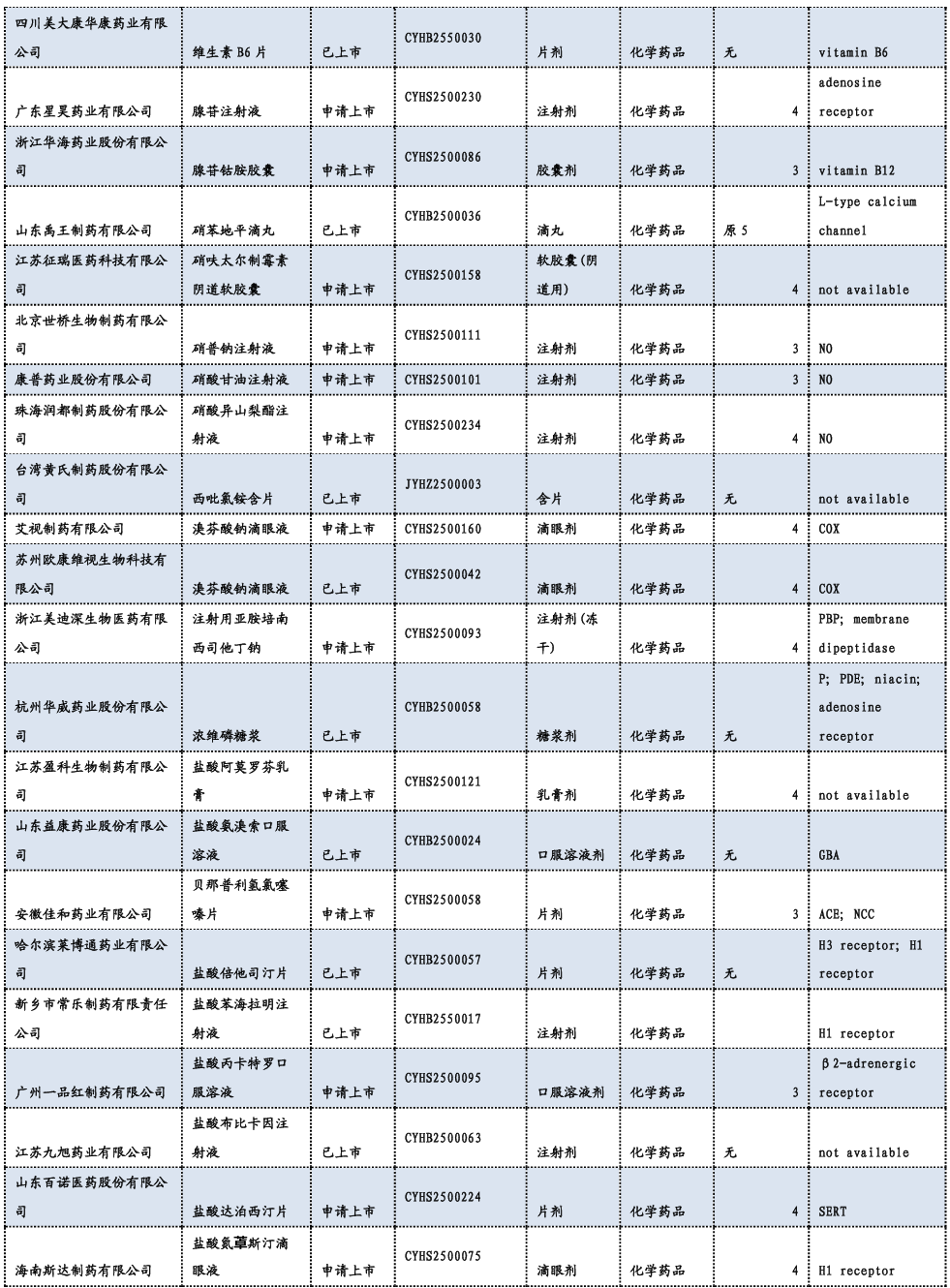
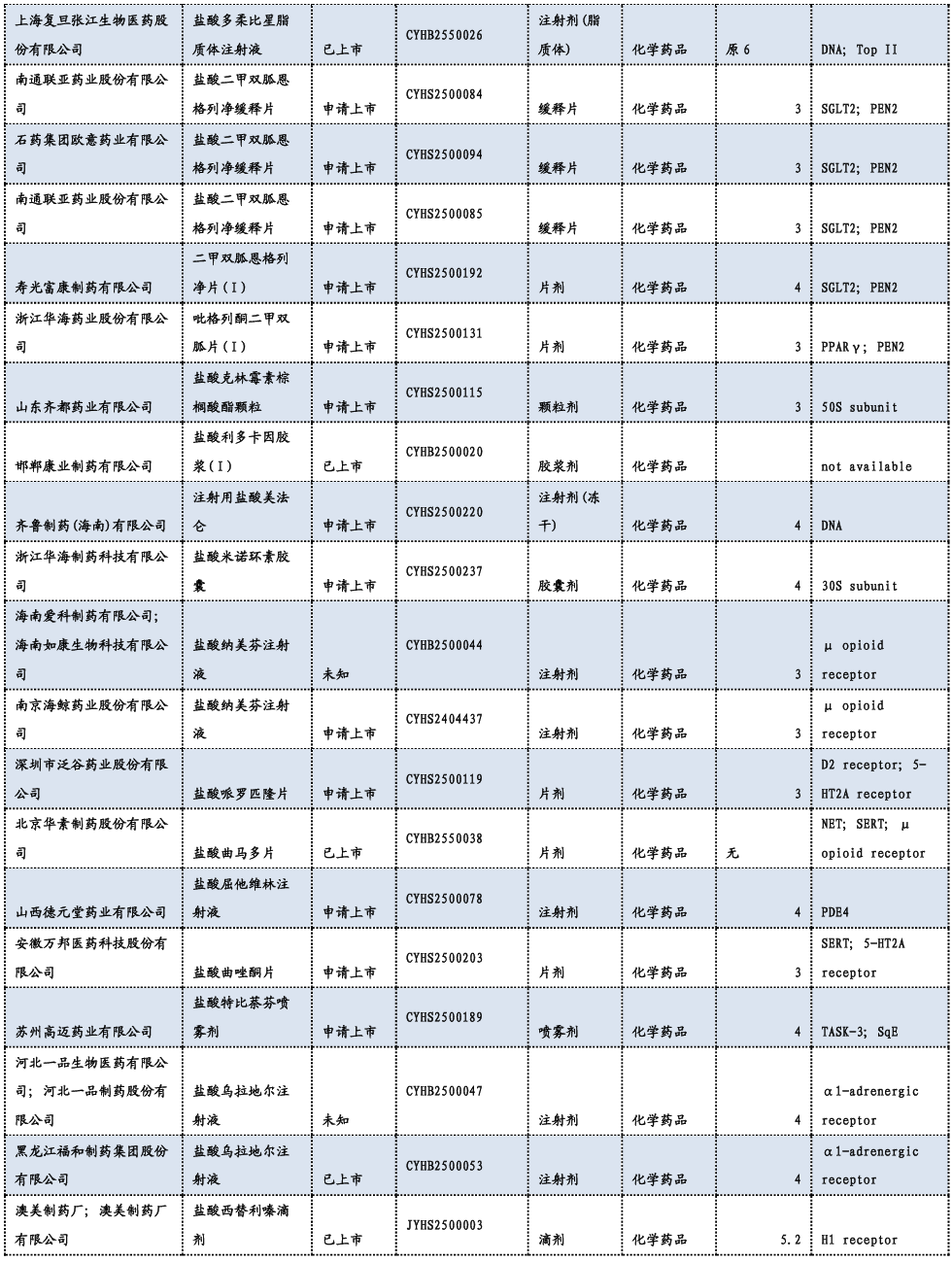
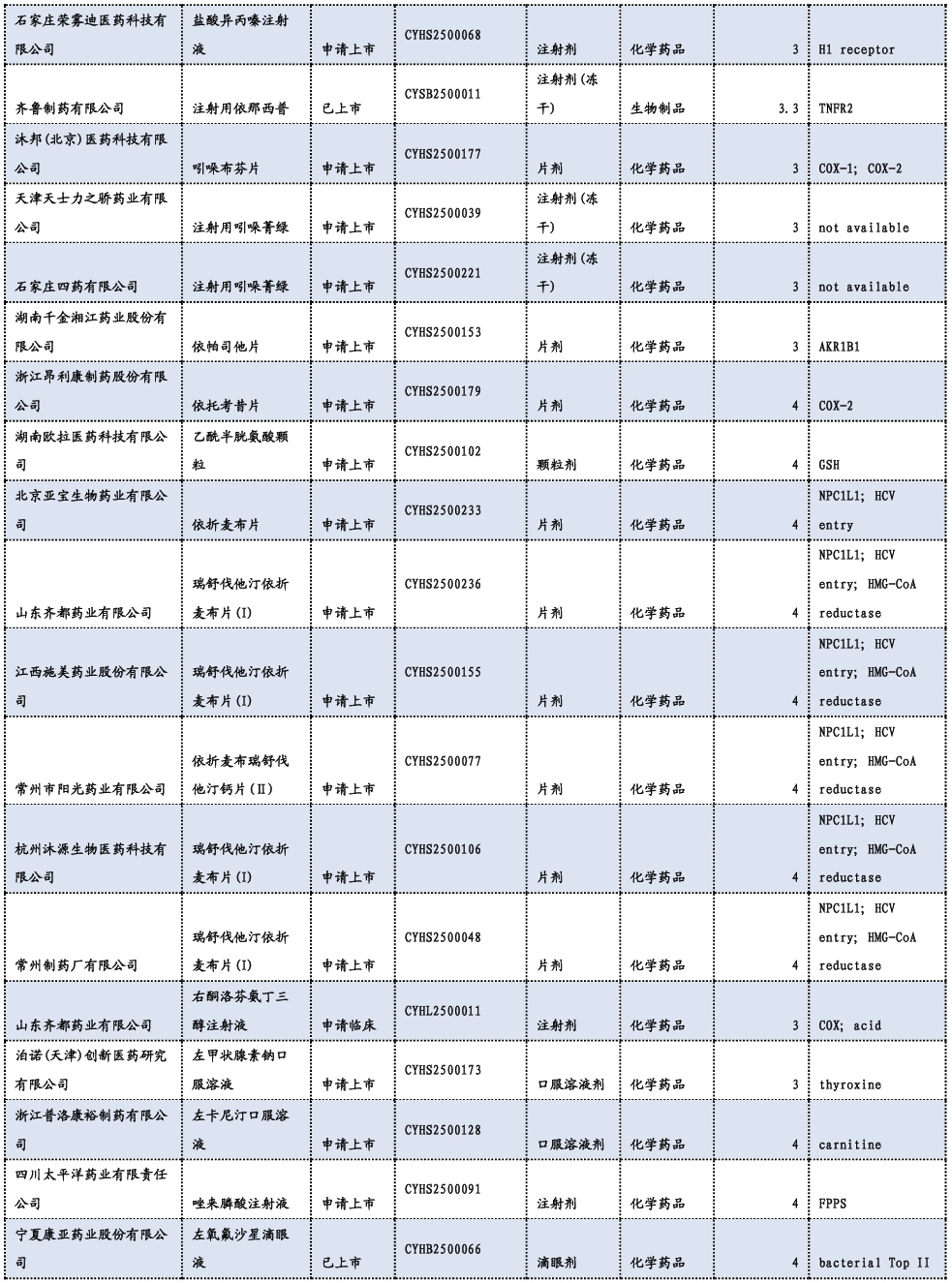
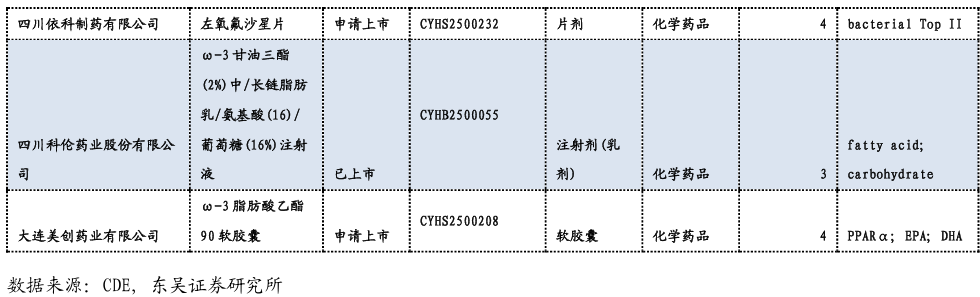
3.3. 重要研发管线一览
1月10日,三迭纪IgA肾病药物产品D23取得积极临床结果,验证精准肠道靶向递送能力。三迭纪宣布,其3D打印药物产品D23在临床研究中取得了积极结果。D23是三迭纪自主研发的口服布地奈德迟释片,是一款针对IgA肾病的改良型药物,于2024年3月29日获得国家药监局(NMPA)新药临床试验。
1月9日,三生国健(688336.SH)自主研发的抗TL1A单抗(研发代号:SSGJ-627)临床试验申请获国家药品监督管理局受理,成为首个申报临床试验并获受理的国产抗TL1A单抗。
4. 行业洞察与监管动态
1月9日,为进一步规范化学仿制药口服制剂经肠内营养管给药体外对比研究的技术要求,药审中心组织制定了《化学仿制药口服制剂经肠内营养管给药体外对比研究技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
1月9日,为鼓励新药研发,在国家药品监督管理局的部署下,药审中心组织制定了《治疗子宫内膜癌新药临床研发技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
1月10日,为进一步推动抗猴痘病毒药物的研发,为该类药物临床试验设计提供可供参考的技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《抗猴痘病毒药物临床试验技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
1月10日为指导预防用猴痘疫苗非临床药效学试验的设计,药审中心组织制定了《预防用猴痘疫苗非临床有效性研究技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。

5. 行情回顾
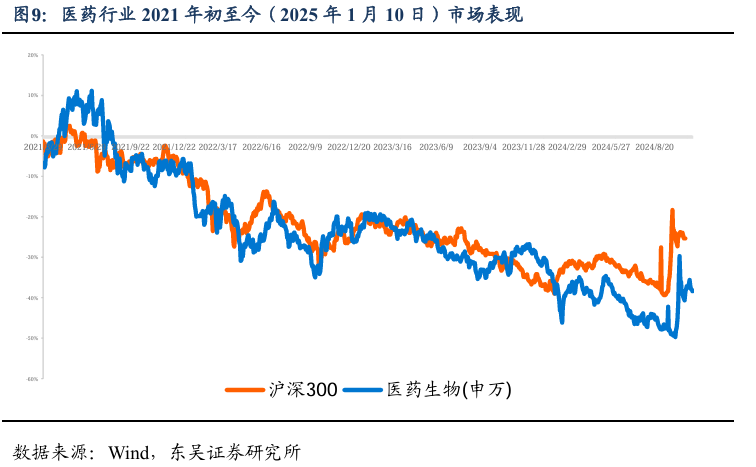
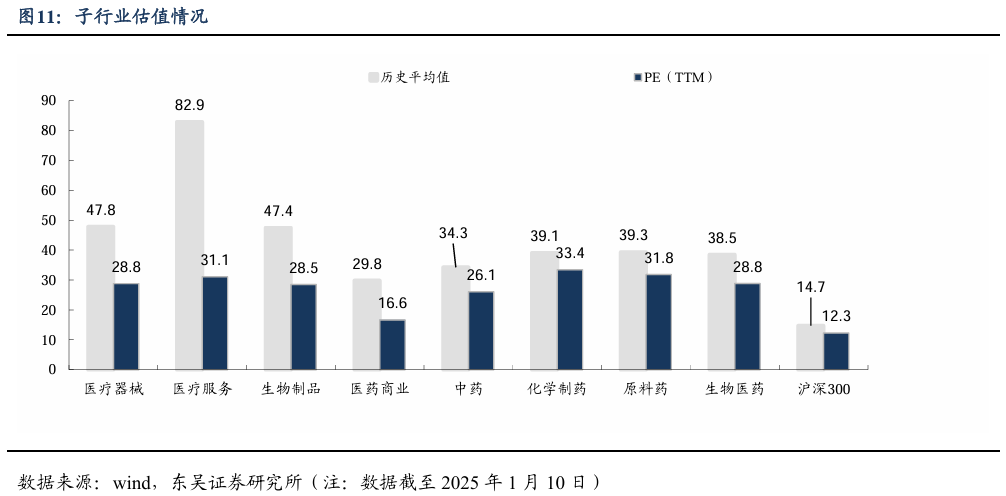
5.1. 医药市盈率追踪:医药指数市盈率为28.8,较历史均值低9.70
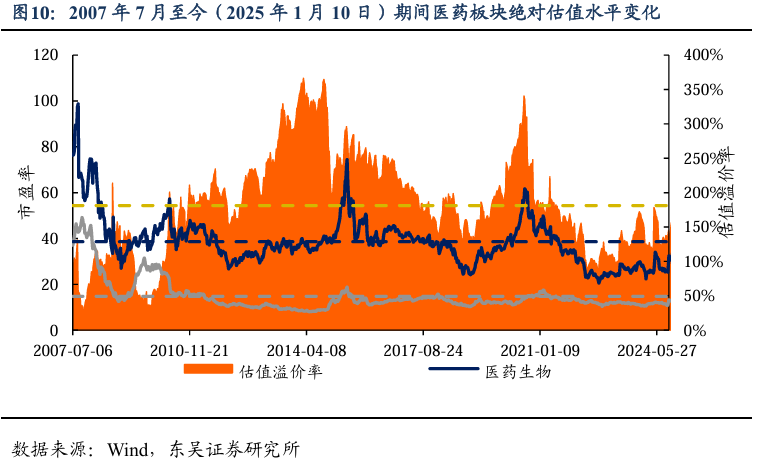
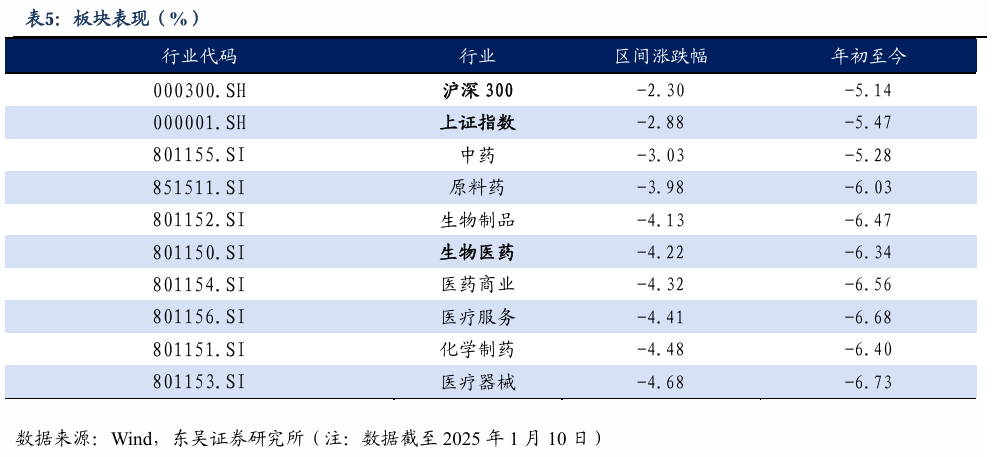
5.2. 医药子板块追踪:本周医药下降-3.03%,优于其他子板块
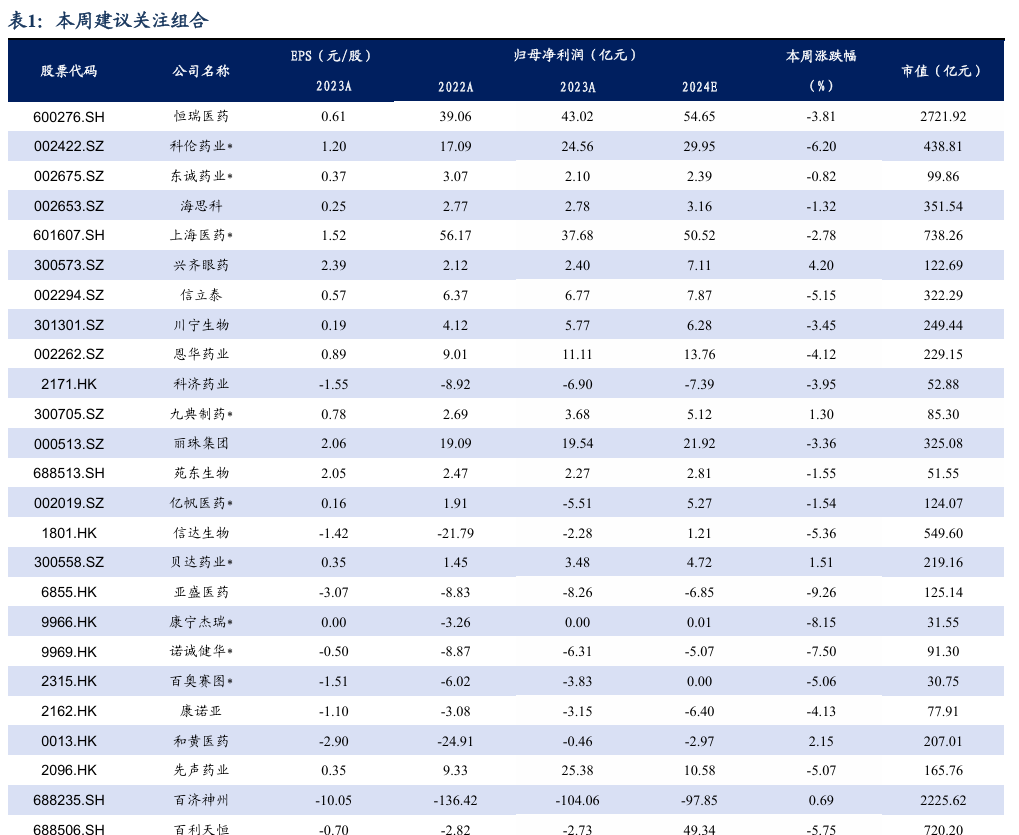
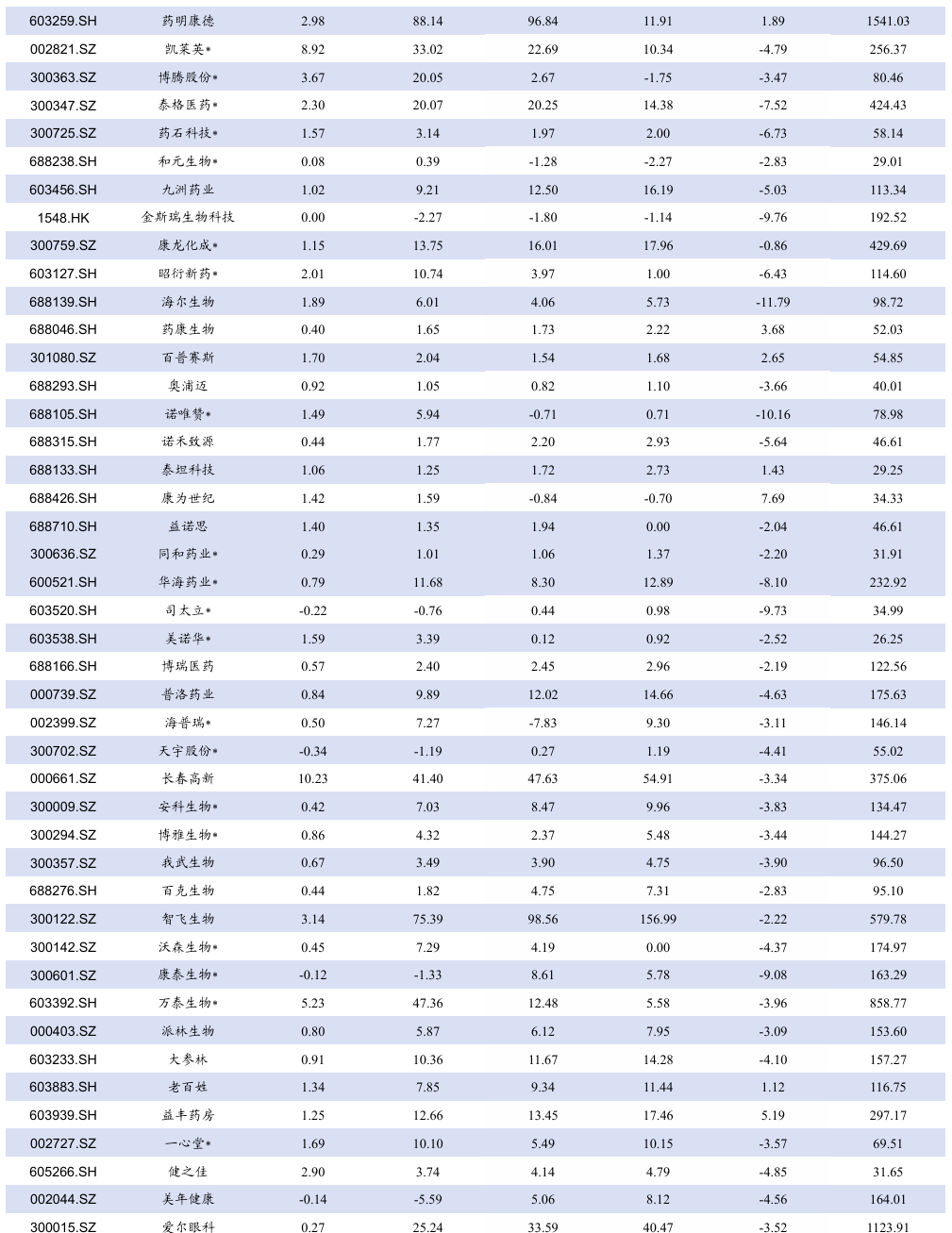
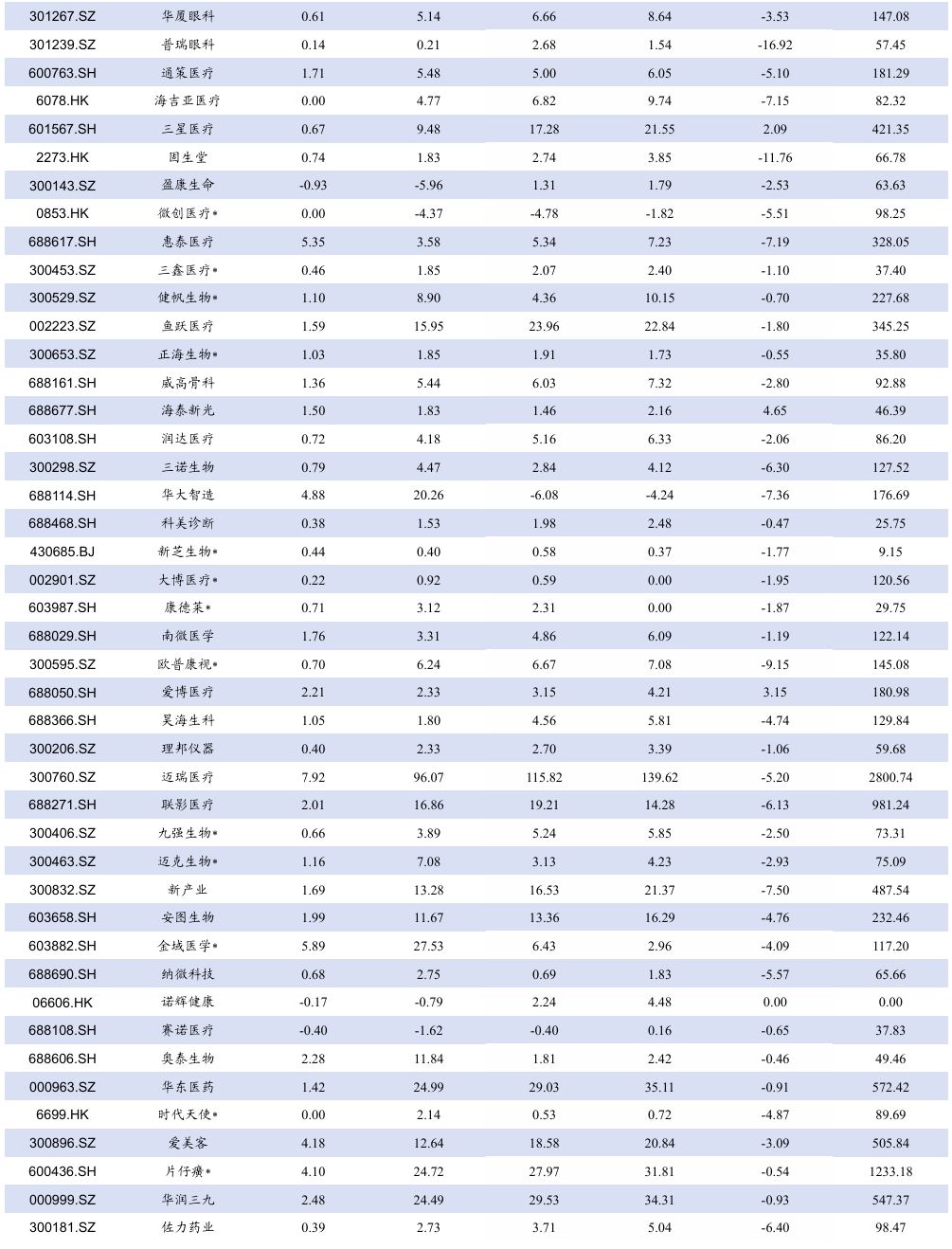
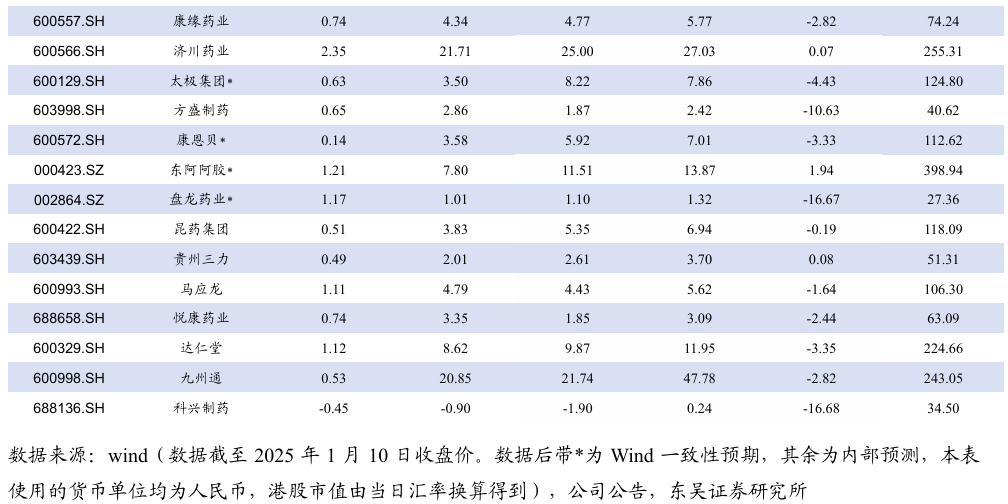
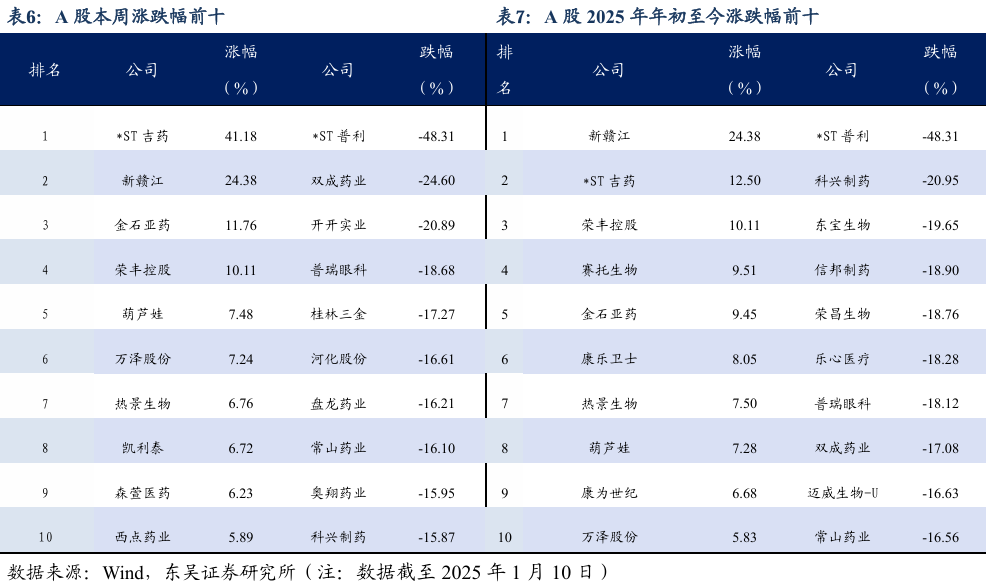
5.3. 个股表现
6. 风险提示
1、药品或耗材降价幅度继续超预期:
国家加大集采范围,药品和耗材的集采带来了药品和耗材的大幅降价,随着国内医药和器材市场的竞争加剧,集采对降价的推动作用将会更加明显,未来药品和耗材集采降价幅度可能会超预期,对企业的利润造成较大影响。
2、医保政策进一步严厉等:
医保局作为中国医药行业最大单一支付方,其支付政策变化可能直接导致相关公司盈利水平发生显著变化。
3、产品销售及研发进度不及预期。
7. 附录





 VIP复盘网
VIP复盘网
