Singpath-VL模型:赋予AI"证据驱动"的诊断思维,开源数据集助力临床研究
在显微镜下寻找宫颈细胞的细微异常,是病理医生日复一日的重要工作。安必平人工智能实验室(Singpath AI Lab)尝试研发出一个辅助病理医生诊断的助手,名为Singpath-VL的视觉语言模型,它不再是"黑盒"猜出诊断结果,而是尝试模仿病理医生观察、分析和推理。
为了促进业界研究,我们将开源其构建的大规模细胞图像描述数据集及测试基准,也期待更多的技术团队一起研究解决临床问题。
当AI成为"黑箱",医生如何信任?
当前,许多医学AI模型都是和黑状态:输入一张图像,它直接输出一个诊断标签。至于"为什么是这个诊断?"、"它看到了哪些关键特征?"——模型无法给出令人信服的解释。
然而,宫颈细胞学的诊断(如TBS系统分类)本身就是一个严谨的推理过程。医生需要综合评估细胞核的大小、形状、染色深浅、核质比等一系列形态学特征,才能做出"正常(NILM)"、"非典型鳞状细胞(ASC-US)"或"低度/高度鳞状上皮内病变(LSIL/HSIL)"等判断。
无法展示推理过程,在复杂的临床场景中很难获得医生的完全信赖,我们尝试做整个判读的归因链路的分析AI,因此诞生了Singpath-VL。
教会AI"先找证据,再下结论"
Singpath-VL的工作方式模拟了医生的诊断思维链:
第一步:形态特征识别。模型首先像医生的眼睛一样,扫描图像,系统地识别出关键的异常形态学改变,如核增大、核深染、挖空等。
第二步:逻辑整合诊断。然后,模型会像医生的大脑一样,根据细胞病理学的诊断标准(TBS系统),将这些识别出的"特征证据"进行整合,最终推导出诊断结论,并能够生成相应的诊断依据。
"我们不只是让AI学习'是什么',更重要的是让它理解'为什么'。" 核心思路在于,让AI的决策过程变得透明、可追溯,从而建立起与临床医生协作的信任基础。
如何"喂"给AI海量的专业知识?
训练一个专业的细胞学AI,最大的难题在于缺乏高质量的"教材"——即大量精准标注了形态描述和诊断结论的细胞图片。
我们设计了一条"AI合成流水线"来解决这个数据荒问题:
▪ 初筛:先让多个通用的视觉语言AI对同一张细胞图片进行描述。
▪ 共识:再用大语言模型对这些描述进行"会诊",融合共识,消除矛盾。
▪ 精修:最后引入病理学领域知识,对描述进行最终的润色与修正。
通过这条流水线,构建了名为 Singpath-CytoText 的大规模图文数据集,为模型提供了扎实的学习材料。
AI助手实战如何?
为了验证模型的能力。我们建立了两个核心测试基准:
1. "火眼金睛"测试——识别细胞形态特征
在识别核增大、深染等9项关键形态特征的任务中,Singpath-VL的平均准确率达到了89.0%。作为对比,参与构建测试集的病理医生小组内部一致性约为78.2%。这表明,在稳定识别特定形态特征方面,模型展现出了高度可靠性。
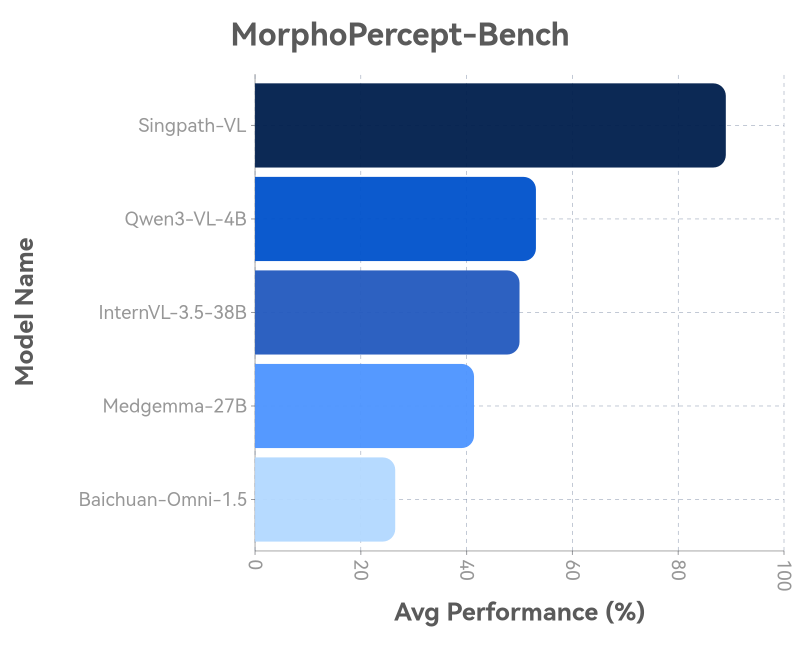
Singpath-VL在形态特征识别任务上表现优异,优于其他多模态大模型
2. "诊断决断"测试——TBS分类
在一个包含超过2.9万个细胞、涵盖NILM、ASC-US、LSIL、ASC-H、HSIL、AGC等各类别的测试集上,Singpath-VL的总体诊断准确率为80.2%。
尤其值得关注的是,在ASC-US(意义不明的非典型鳞状细胞)和ASC-H(不能排除高度病变的非典型鳞状细胞) 这些临床诊断的"灰色地带"和难点上,Singpath-VL展现出了比单纯图像分类模型更强的判别能力。
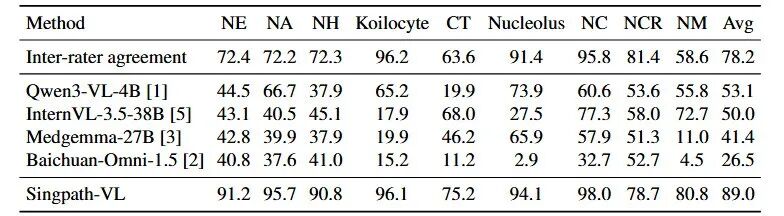
Singpath-VL在TBS诊断分类中的准确率(%)
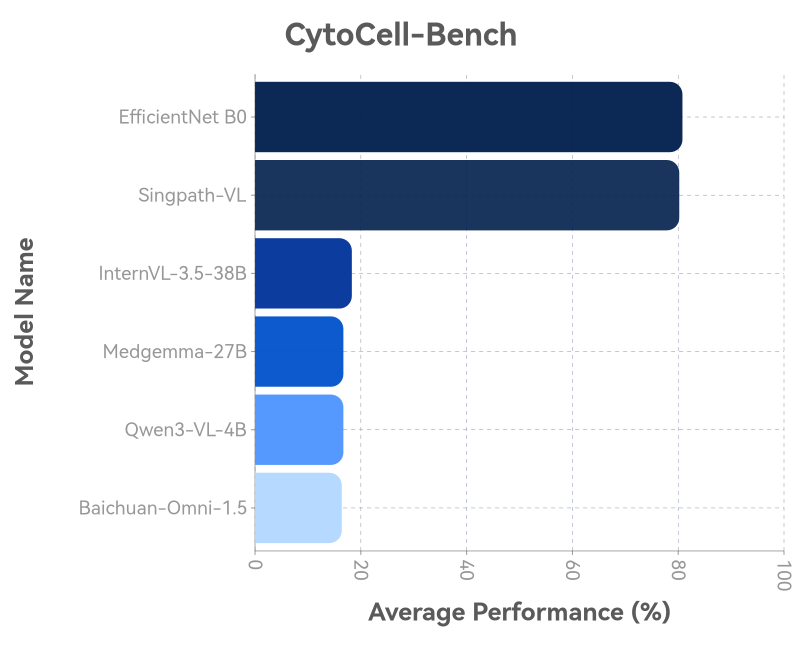
Singpath-VL在各类别诊断中表现均衡且稳健,显著优于其他多模态大模型
AI如何辅助鉴别诊断?
案例一:避免"过度诊断"
下图是一例正常的宫颈细胞(NILM)。通用AI模型错误地提示异常。而Singpath-VL准确地识别出其正常的形态特征,并给出了"NILM"的正确判断,有助于减少不必要的恐慌和进一步检查。
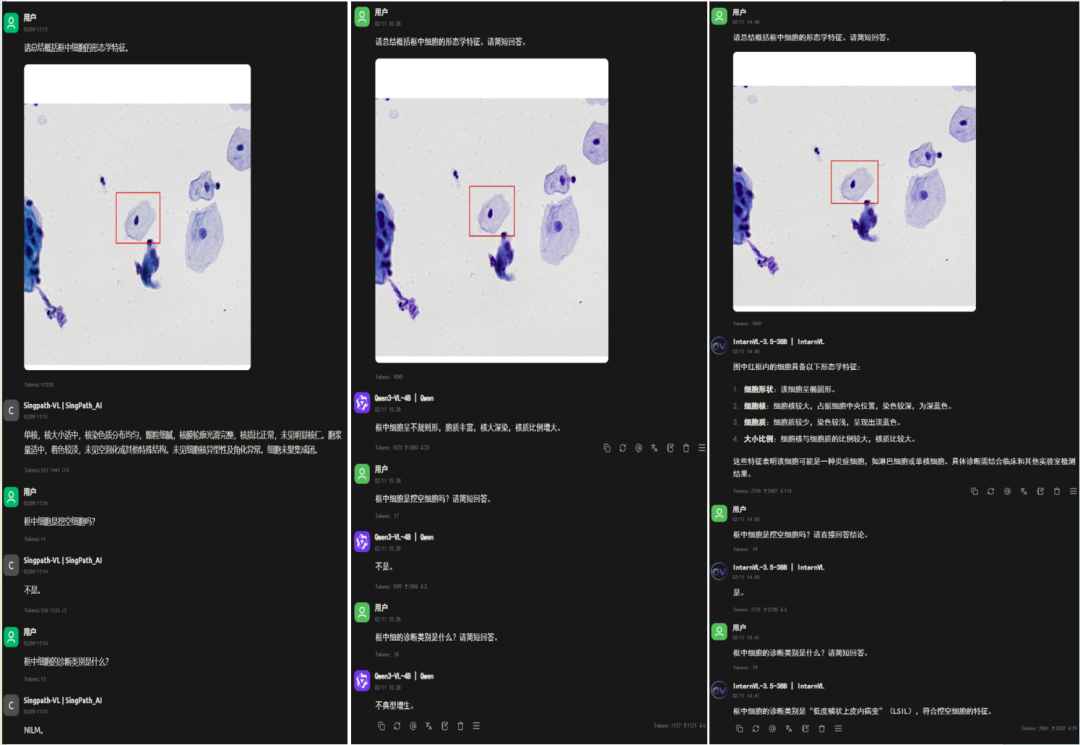
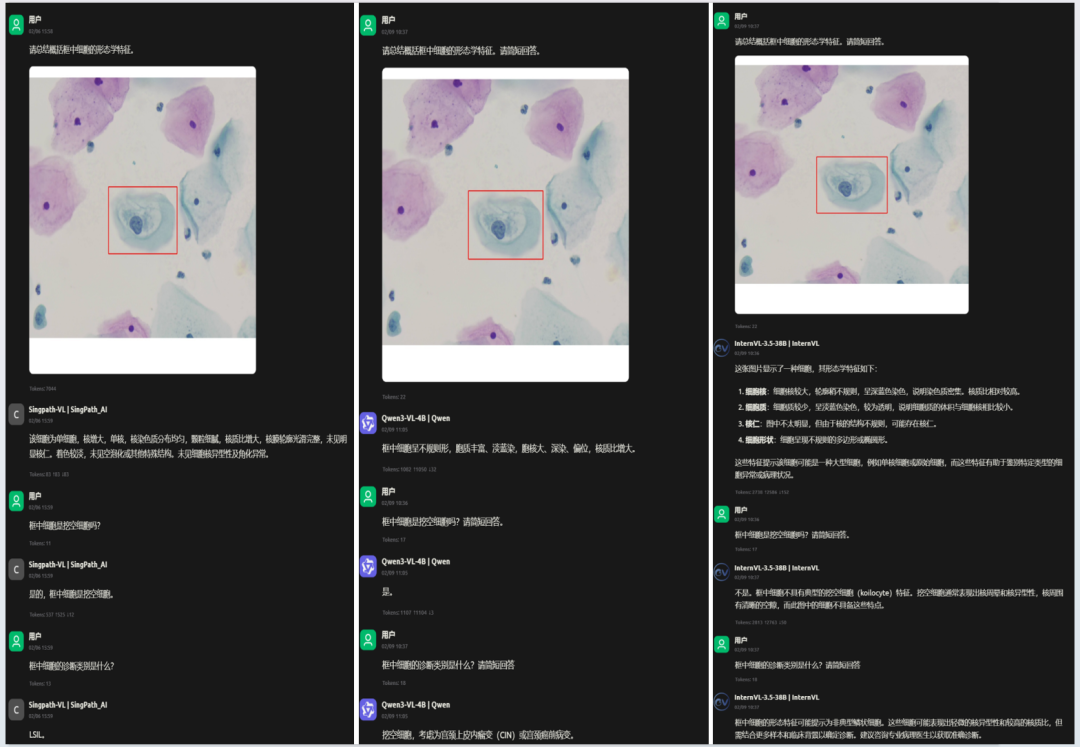
案例二:精准捕捉低度病变
下图是一例明确的LSIL(低度鳞状上皮内病变)细胞。Singpath-VL不仅准确诊断为LSIL,其推理过程也清晰地指向了"细胞核增大、挖空"等关键证据。而其他模型则产生误判。
数据开源
为推动可解释性AI在细胞病理学领域的进步,LBP Singpath AI Lab将向学术界和产业界开源部分数据。我们希望这些资源能成为一个公共的"起跑线"和"测试场",吸引更多医生和科学家一同参与,共同开发下一代真正懂医生、助医生的临床AI工具。
全新LBC辅助诊断平台已上线
Singpath AI Lab已推出全新一代LBC(液基细胞学)辅助诊断平台,将AI能力带入日常工作流程。其中AI性能达到敏感性95% 、特异性85%。
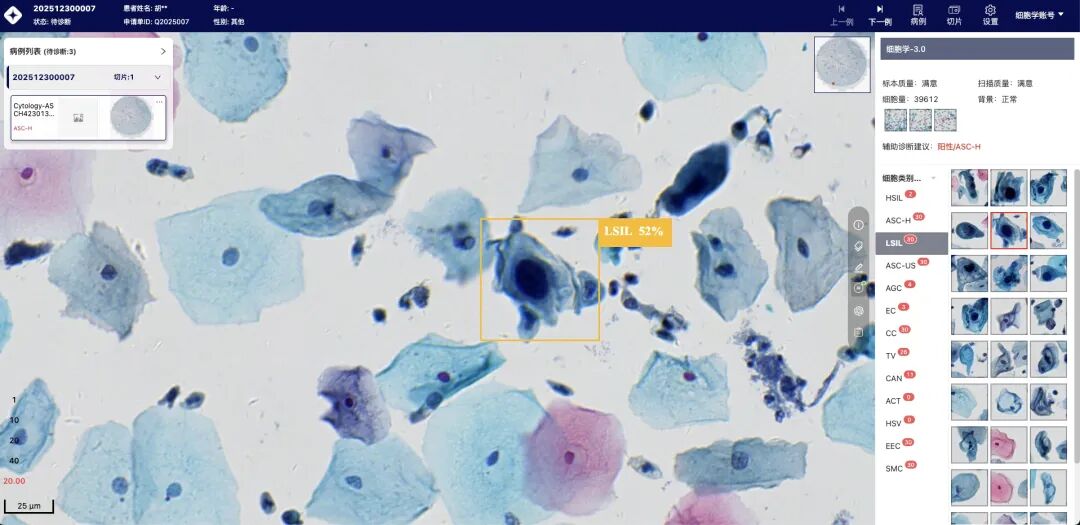
平台预览:清晰的界面设计,直观展示可疑阳性细胞与诊断结果



 VIP复盘网
VIP复盘网
